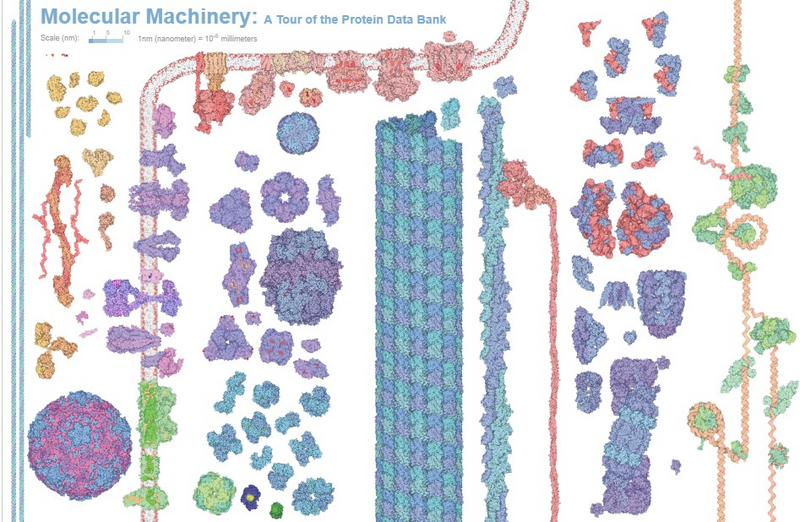
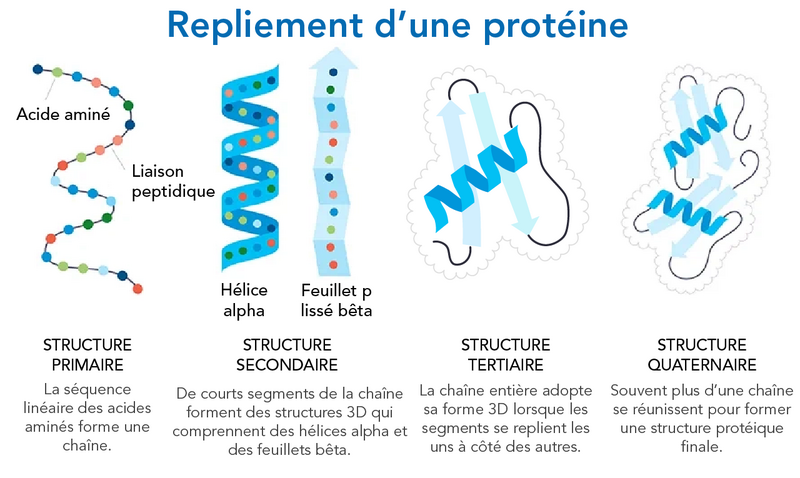
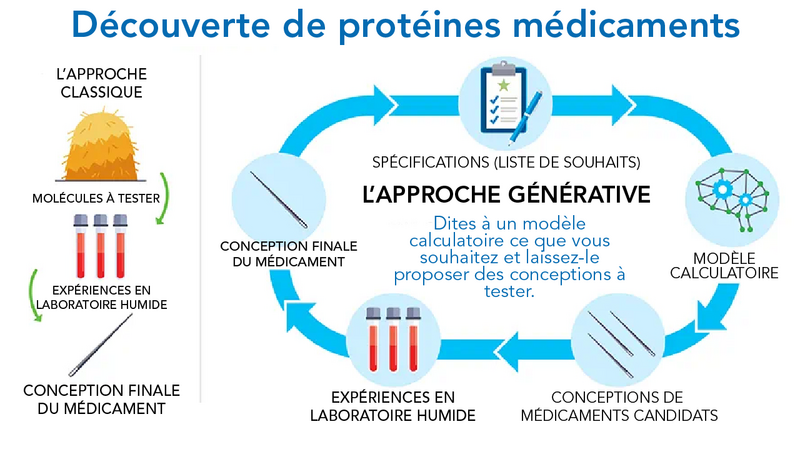
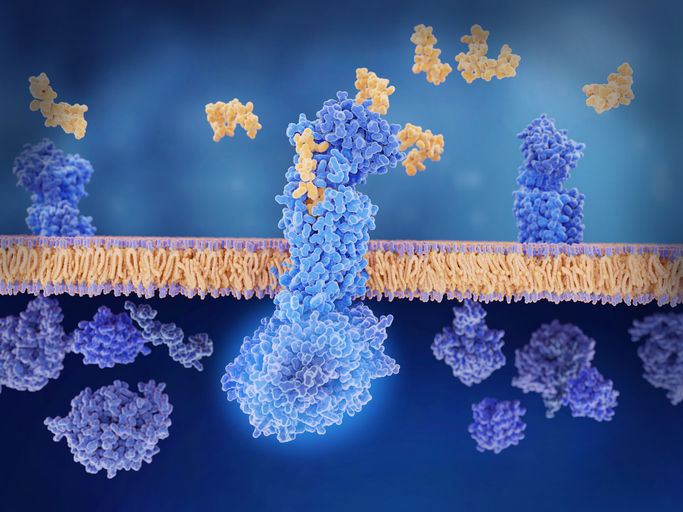
Découvrir des médicaments à l’aide de l’apprentissage machine

Personne en blouse blanche pointant vers le bouton AI (Suriphon Singha, Getty Images)

Personne en blouse blanche pointant vers le bouton AI (Suriphon Singha, Getty Images)
Quels sont les liens avec mon programme d'études?
BC
12
Anatomie et physiologie 12 (Août 2018)
Grandes idée: L’expression génique, par la synthèse des protéines, est l’interaction entre les gènes et l’environnement.
YT
12
Anatomie et physiologie 12 (Colombie britannique, Août 2018)
Grandes idée: L’expression génique, par la synthèse des protéines, est l’interaction entre les gènes et l’environnement.
BC
12
Anatomie et physiologie 12 (Août 2018)
Grandes idée: L’homéostasie est assurée par des processus physiologiques.
ON
12
Sciences, 12e année, cours préuniversitaire/ précollégial (SNC4M) (2008)
D: Science de la nutrition
YT
12
Anatomie et physiologie 12 (Colombie britannique, Août 2018)
Grandes idée: L’homéostasie est assurée par des processus physiologiques.