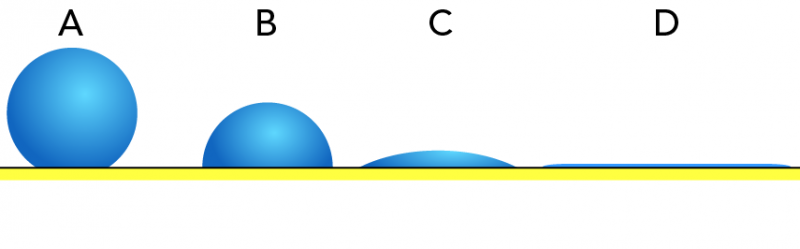
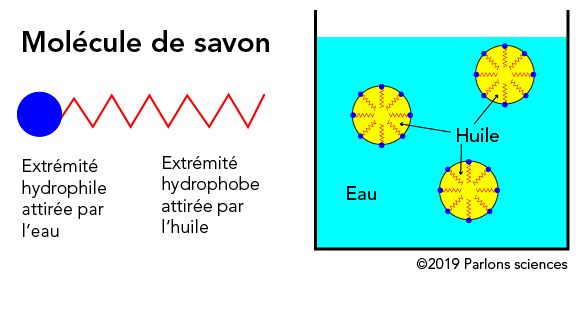
Une mousse prodigieuse

Une personne se lave les mains avec du savon (jacqueline macou, Pixabay)

Une personne se lave les mains avec du savon (jacqueline macou, Pixabay)
7.07
Quels sont les liens avec mon programme d'études?
Curriculum Alignment
BC
11
Chimie 11 (Août 2018)
Grandes idée: La chimie organique et ses applications ont d’importantes répercussions sur la santé humaine, la société et l’environnement.
NU
12
Chimie 30 (Alberta, 2008, Révision 2014)
Unité C: Transformations chimiques des composés organiques
YT
11
Chimie 11 (Colombie britannique, Août 2018)
Grandes idée: La chimie organique et ses applications ont d’importantes répercussions sur la santé humaine, la société et l’environnement.
NT
12
Chimie 30 (Alberta, 2008, Révision 2014)
Unité C: Transformations chimiques des composés organiques
AB
11
Sciences 24 (2004, Révision 2014)
Unité A: Applications de la matière et de la transformation chimique
BC
10
Sciences 10 (Mars 2018)
Grandes idée: Les processus chimiques de réarrangement des atomes nécessitent des échanges d’énergie avec le milieu environnant.
BC
11
Chimie 11 (Août 2018)
Grandes idée: Lors de réactions chimiques, la matière et l’énergie sont conservées.
NU
11
Sciences 24 (Alberta, 2004, Révision 2014)
Unité A: Applications de la matière et de la transformation chimique
NU
10
Sciences 10 (Colombie britannique, 2015)
Grandes idée: Les processus chimiques de réarrangement des atomes nécessitent des échanges d’énergie avec le milieu environnant.
YT
11
Chimie 11 (Colombie britannique, Août 2018)
Grandes idée: Lors de réactions chimiques, la matière et l’énergie sont conservées.
NT
11
Sciences 24 (Alberta, 2004, Révision 2014)
Unité A: Applications de la matière et de la transformation chimique