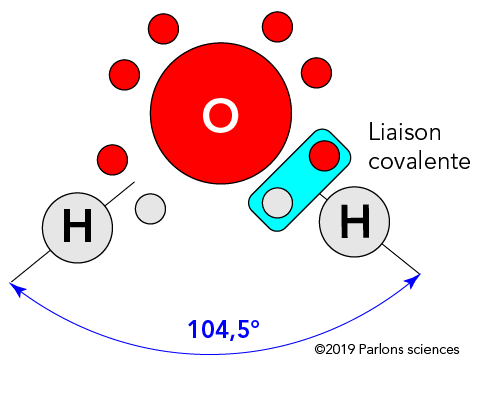
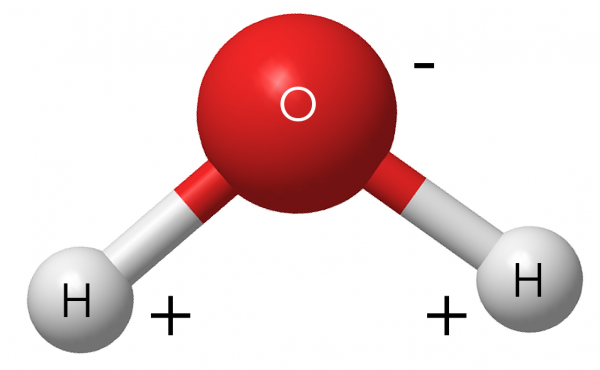
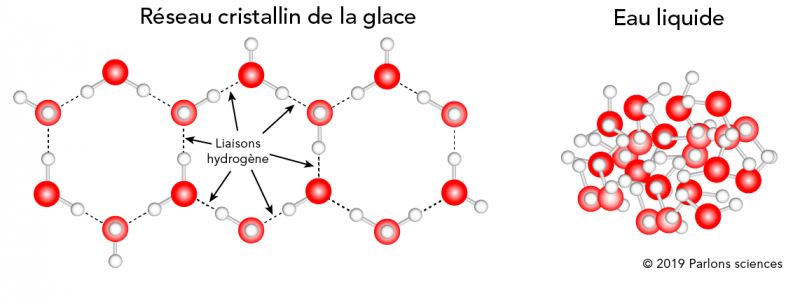
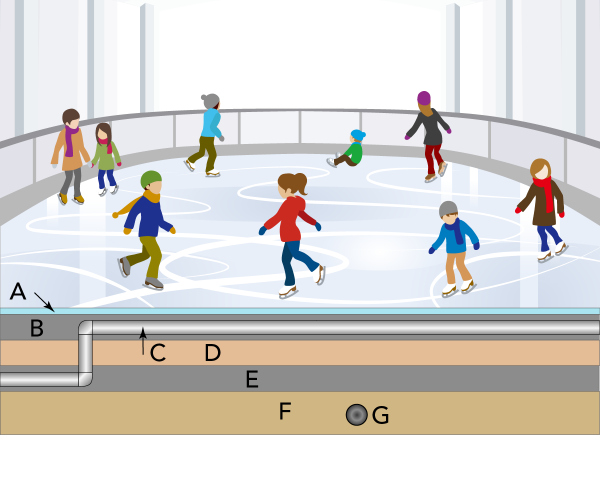
Pourquoi les patinoires restent-elles gelées?

Personnes jouant au hockey (VisualCommunications, iStockphoto)

Personnes jouant au hockey (VisualCommunications, iStockphoto)
7.61
Quels sont les liens avec mon programme d'études?
Curriculum Alignment
BC
8
Sciences 8 (2015)
Grandes idée: Le comportement de la matière peut être expliqué par la théorie cinétique moléculaire et par la théorie atomique.
YT
8
Sciences 8 (Colombie britannique, 2015)
Grandes idée: Le comportement de la matière peut être expliqué par la théorie cinétique moléculaire et par la théorie atomique.
ON
5
Sciences et technologie 5e année (2022)
Domaine C. Les propriétés et les changements de la matière
MB
2
Sciences de la nature, 2e année (1999)
Regroupement 2: Les propriétés des solides, des liquides et des gaz
NS
2
Sciences : de la maternelle à la 6e année (2019)
Sciences de la Terre et de l’espace – L’air et l’eau dans l’environnement
NU
2
K-6 Science and Technology Curriculum (NWT, 2004)
Matter and Materials: Properties of Liquids and Solids
NU
2
K-6 Science and Technology Curriculum (NWT, 2004)
Earth and Space Systems: Air and Water in the Environment
NT
2
K-6 Science and Technology Curriculum (NWT, 2004)
Matter and Materials: Properties of Liquids and Solids
NT
2
K-6 Science and Technology Curriculum (NWT, 2004)
Earth and Space Systems: Air and Water in the Environment
AB
3
Sciences 3 (2023)
Matière : La compréhension du monde physique est approfondie en étudiant la matière et l’énergie.
BC
11
Chimie 11 (Août 2018)
Grandes idée: Les atomes et les
molécules sont les
éléments constituants
de la matière.
YT
11
Chimie 11 (Colombie britannique, Août 2018)
Grandes idée: Les atomes et les
molécules sont les
éléments constituants
de la matière.
ON
12
Sciences de la Terre et de l’espace,12e année, cours préuniversitaire (SES4U) (2008)
C: Matériaux géologiques
BC
11
Chimie 11 (Août 2018)
Grandes idée: La mole est une quantité utilisée pour rendre les atomes et les molécules mesurables.