Les moles et la concentration molaire : Comptage et chimie, des beignets au savon

Une taupe (mole en anglais) et le nombre d’atomes ou de molécules dans une mole (nwbob, iStockphoto)

Une taupe (mole en anglais) et le nombre d’atomes ou de molécules dans une mole (nwbob, iStockphoto)
Quels sont les liens avec mon programme d'études?
| Classe | Cours | Sujet |
|---|
Pour compter de minuscules choses comme les atomes et les molécules, les scientifiques utilisent une mesure appelée la mole.
Le savais-tu?
En anglais, mole est aussi le nom de la taupe. C'est pourquoi vous voyez parfois la taupe comme mascotte en chimie!
Imaginez que vous travaillez dans un café vendant des beignets. Le client entre et vous demande une douzaine de beignets. Vous comptez donc douze beignets et les emballez pour le client. Très rapidement, vous avez fini de servir le client.

Plus tard, un autre client arrive avec une commande inhabituelle. Il ne veut pas d’une boîte standard de douze beignets. Il veut une commande spéciale comprenant vingt-quatre beignets décorés de dix mille perles sucrées pour célébrer le fait qu’il ait atteint dix mille abonnés sur Instagram.
C’est une demande un peu bizarre, mais votre gérant vous dit de le faire.
Alors, vous voilà, à compter les perles individuelles. Rendu(e) à la perle 110, vous commencez à penser qu’il doit exister une meilleure façon. Une idée vous vient à l’idée : « Puis-je utiliser la balance de cuisine pour faire le comptage pour moi ? »
Donc, vous prenez les 110 perles que vous avez déjà comptées et mettez-les sur la balance. La lecture indique 0,19 grammes. Maintenant que vous savez combien 110 perles pèsent, vous pouvez calculer combien 10 000 perles pèseront.
(0,19 g)/(110 perles) x 10 000 perles = 17,27 g de perles
Vous pesez soigneusement 17,27 grammes de perles. Vous êtes assez satisfait(e) du temps que vous avez économisé en ne comptant pas les perles une par une!
Qu’est-ce qu’une mole?
Les scientifiques utilisent une méthode similaire pour déterminer combien d’atomes ou de molécules il y a dans une substance. Ils doivent le faire afin de pouvoir combiner les quantités adéquates de produits chimiques pour les réactions chimiques. Cependant, contrairement aux perles, il est physiquement impossible de compter les atomes ou les molécules. Ils sont trop petits!
Pour résoudre ce problème, les scientifiques utilisent une unité de mesure qui permet d’établir la relation entre une quantité de quelque chose et le nombre correspondant d’atomes ou de molécules. Les beignets sont habituellement vendus à la douzaine, et il y a 12 beignets dans une douzaine. De même, les atomes et les molécules peuvent être mesurés en moles (symbole : mol). Il y a 602 200 000 000 000 000 000 000 unités par mole.
C’est beaucoup de zéros! Pour travailler avec des nombres importants comme celui-ci, les gens utilisent la notation scientifique. C’est une façon plus courte d’écrire un grand nombre. L’utilisation de la notation scientifique réduit les risques de faire une erreur!
Pour utiliser la notation scientifique :
- comptez à partir de la virgule décimale dans le nombre jusqu’à ce qu’il n’y ait qu’un seul chiffre restant à gauche
- déplacez la décimale à cet endroit
- multipliez par 10 à la puissance du nombre de décimales que vous avez compté
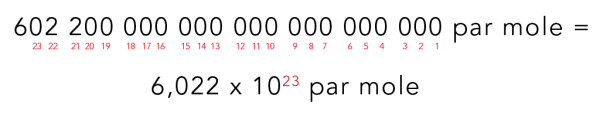
Ainsi, la notation scientifique utilisée pour calculer une mole est de 6,022 x 1023.
Maintenant, essayons d’estimer la taille d’une mole en calculant la masse d’une mole de perles:
(0,19 g)/(110 perles)*
x
6,022 x 1023 perles/mole†
=
1,04 x1021 g/mol‡
x
(1 kg)/(1000 g)§
=
1,04 x1018 kg/mol¶
- *110 perles ont une masse de 0,19 grammes.
- †6,022 x 1023 est le nombre d’unités dans une mole.
- ‡1,04 x1021 g/mol est la masse d’une mole de perles en grammes.
- §(1 kg)/(1000 g) est la conversion de grammes en kilogrammes. Il y a 1000 grammes dans un kilogramme.
- ¶1,04 x 1018 kg/mol est la masse d’une mole de perles en kilogrammes
Une mole de perles représente plus de 260 000 fois la masse de nourriture produite pour la consommation humaine chaque année sur Terre! Donc, vous ne verrez jamais une mole de perles!
Le savais-tu?
Le nombre d’unités dans une mole est si grand, vous n’auriez jamais assez de temps pour faire le comptage. En fait, si tous les humains ayant jamais existé passaient toute leur vie à compter des objets un par un, même ensemble, ils n'atteindront toujours pas une mole.
Comment l’utilisation des moles aide-t-elle les scientifiques?
Les atomes et les molécules sont beaucoup plus petits que les perles. La mole existe afin de permettre aux scientifiques de travailler avec de si minuscules particules.
Par exemple, les diamants sont faits de carbone. Une mole d’atomes de carbone a une masse d’environ 12 grammes. Le diamant Tiffany, l’un des plus grands diamants au monde, pèse environ 26 grammes. C’est plus de deux moles de carbone. Ainsi, la mole des atomes est une quantité simple pour les gens à mesurer.

Le nombre de particules dans une mole, 6,022 x 1023, est souvent appelé la constante d’Avogadro ou nombre d’Avogadro. Il est nommé d’après Amedeo Avogadro, un physicien italien.
Alors, à quelle occasion est-ce que quelqu’un utiliserait-il la constante d’Avogadro? Assurément, lorsque l’on doit créer une solution qui implique de nombreuses réactions chimiques. Lors de l’exécution d’une réaction, vous devez combiner le nombre approprié de molécules de chaque produit chimique utilisé, selon le nombre de moles requises.
Pour déterminer la quantité d’une solution à utiliser, les chimistes utilisent la concentration molaire (ou molarité). C’est le nombre de moles d’un produit chimique dans un litre de solution.
Une concentration de 1 mole dans 1 litre se nomme 1 molaire et est écrit 1 mol/L.
Pour voir cela en action, imaginons que vous êtes un chimiste qui essaie de fabriquer du savon. Vous devez faire réagir de l’huile végétale ou de la graisse animale avec de l’hydroxyde de sodium (aussi appelée soude caustique) pour produire du savon. Imaginez que vous avez mesuré une quantité d’huile et déterminé qu’elle contenait 0,2 moles de molécules de graisse, appelées triglycérides.
Dans la réaction de fabrication du savon, 1 mole de triglycérides réagit avec 3 moles d’hydroxyde de sodium. Alors, de quelle quantité de solution d’hydroxyde de sodium 12 mol/L (12 molaires) avez-vous besoin afin de réagir avec l’huile végétale contenant 0,2 moles de triglycérides?

Première étape : Calculer les moles d’hydroxyde de sodium nécessaires
Multipliez les moles de triglycérides nécessaires par le ratio des réactifs (le nombre de moles d’hydroxyde de sodium divisé par 1 mole de triglycérides):
0,2 mol de triglycérides x (3 mol d’hydroxyde de sodium)/(1 mol de triglycérides) = 0,6 mol d’hydroxyde de sodium
Deuxième étape : Calculer le volume de solution d’hydroxyde de sodium 12 mol/L nécessaire
Nombre de moles = concentration molaire x volume
Réorganisez ceci pour trouver la formule qui permettra de calculer le volume :
Volume = nombre de moles / concentration molaire
= 0,6 mol d’hydroxyde de sodium / 12 mol/L = 0,05 L de solution d’hydroxyde de sodium (12 mol/L)
Troisième étape : Convertir les litres en millilitres
Pour de petites quantités, comme celles utilisées dans la fabrication du savon, les millilitres représentent une mesure plus utile que les litres. Rappelez-vous, 1L = 1000 ml.
0,05 L x 1000 ml/L = 50 ml
50 ml de solution d’hydroxyde de sodium (12 mol/L) serait nécessaire.
C’était beaucoup d’informations! Résumons les points importants :
- Une mole est un nombre spécifique utilisé pour décrire de très grandes quantités d’atomes ou de molécules minuscules.
- En chimie, il est important de savoir combien de moles il y a dans une solution pour effectuer des réactions, comme faire du savon.
- Les concentrations molaires, ou de moles dans un litre, peuvent vous aider à déterminer la quantité exacte, nécessaire pour une solution.
Le savais-tu?
Le 23 octobre (10/23!), de 6:02 à 18:02, est la journée de la mole. C’est une journée pour célébrer la chimie!
Amorces de discussion
- Avez-vous déjà essayé de mesurer quelque chose qui est très petit? Quels problèmes avez-vous rencontrés
- Avez-vous déjà fait une solution à la maison? De quoi cette solution a-t-elle été faite? Avez-vous mesuré les ingrédients? Si oui, quel type de mesure avez-vous utilisé pour fabriquer votre solution?
- Quelles sont les applications des solutions chimiques utilisées dans l’industrie et en technologie?
- Quels sont les avantages de pouvoir changer la concentration molaire d’une solution?
- Définissez ce qu’est une mole.
- Quelle est la constante d’Avogadro ?
- Qu’advient-il de la concentration molaire d’une solution si elle est diluée?
- Écrivez les chiffres suivants en utilisant la notation scientifique :
- 4 703 700 000 000 000 000
- 99 900 000
- Quelle est la valeur de la notation scientifique?
- Pouvez-vous penser à d’autres unités de mesure que les scientifiques utilisent pour mesurer les articles qui sont très petits ou très grands en termes de taille ou de distance?
- Comment est-ce que les fabricants de détergent annoncent-ils les avantages de leurs détergents plus concentrés? Connaissez-vous d’autres produits qui utilisent la concentration comme argument de vente?
- Cet article soutient l’enseignement et l’apprentissage de la chimie et des mathématiques liés à la concentration molaire et à la stoechiométrie, ainsi que les principes du nombre et de la numération. Les concepts introduits comprennent la mole (mol), la notation scientifique, le carbone, les solutions, la concentration molaire (molarité) et l’unité de mesure mol/L (1 M ou molaire).
- Cet article pourrait être lu avant un laboratoire de chimie pratique impliquant le mélange de solutions.
- Après avoir lu l’article, les enseignants et enseignantes pourraient demander aux élèves de compléter une fiche de stratégie d’apprentissage Toile de définition du concept pour explorer le concept de mole (mol). Les fiches reproductibles prêtes à l’emploi pour cet article sont disponibles dans les formats [Document Google] et [PDF].
- Les enseignants et enseignantes pourraient également demander aux élèves de résoudre des équations de solutions, comme le problème décrit dans l’article, afin d’assurer le suivi de cette lecture et renforcer les concepts et les calculs présentés.
Faire des liens
- Avez-vous déjà essayé de mesurer quelque chose qui est très petit? Quels problèmes avez-vous rencontrés
- Avez-vous déjà fait une solution à la maison? De quoi cette solution a-t-elle été faite? Avez-vous mesuré les ingrédients? Si oui, quel type de mesure avez-vous utilisé pour fabriquer votre solution?
Relier la science et la technologie à la société et à l'environnement
- Quelles sont les applications des solutions chimiques utilisées dans l’industrie et en technologie?
- Quels sont les avantages de pouvoir changer la concentration molaire d’une solution?
Explorer les concepts
- Définissez ce qu’est une mole.
- Quelle est la constante d’Avogadro ?
- Qu’advient-il de la concentration molaire d’une solution si elle est diluée?
- Écrivez les chiffres suivants en utilisant la notation scientifique :
- 4 703 700 000 000 000 000
- 99 900 000
Nature de la science et de la technologie
- Quelle est la valeur de la notation scientifique?
- Pouvez-vous penser à d’autres unités de mesure que les scientifiques utilisent pour mesurer les articles qui sont très petits ou très grands en termes de taille ou de distance?
Littératie médiatique
- Comment est-ce que les fabricants de détergent annoncent-ils les avantages de leurs détergents plus concentrés? Connaissez-vous d’autres produits qui utilisent la concentration comme argument de vente?
Suggestions pour l'enseignement
- Cet article soutient l’enseignement et l’apprentissage de la chimie et des mathématiques liés à la concentration molaire et à la stoechiométrie, ainsi que les principes du nombre et de la numération. Les concepts introduits comprennent la mole (mol), la notation scientifique, le carbone, les solutions, la concentration molaire (molarité) et l’unité de mesure mol/L (1 M ou molaire).
- Cet article pourrait être lu avant un laboratoire de chimie pratique impliquant le mélange de solutions.
- Après avoir lu l’article, les enseignants et enseignantes pourraient demander aux élèves de compléter une fiche de stratégie d’apprentissage Toile de définition du concept pour explorer le concept de mole (mol). Les fiches reproductibles prêtes à l’emploi pour cet article sont disponibles dans les formats [Document Google] et [PDF].
- Les enseignants et enseignantes pourraient également demander aux élèves de résoudre des équations de solutions, comme le problème décrit dans l’article, afin d’assurer le suivi de cette lecture et renforcer les concepts et les calculs présentés.
En savoir plus
La constante d'Avogadro (2017)
Vidéo (1:48) de Mediachimie expliquant ce qu’est la constante d’Avogadro
La quantité de matière (la mole) (2018)
Cette vidéo (4:19) de L'Antisèche explique ce qu’est une mole et comment elle est utilisée en chimie et physique.
Le balancement d'équations chimiques ou Équilibrer une équation chimique (2018)
Cette vidéo (5:23) d’Alloprof explique comment balancer une équation chimique.
Références
Capri, A. (2003). The mole and atomic mass. Visionlearning.
Criswell, B. (2008). Teaching Avogadro’s hypothesis and helping students to see the world differently. Journal of Chemical Education, 85(10), 1372. DOI: 10.1021/ed085p1372
Helmenstine, A. M. (2019). What is a mole in chemistry? ThoughtCo.
LibreTexts. (2019). The mole and Avogadro’s constant.