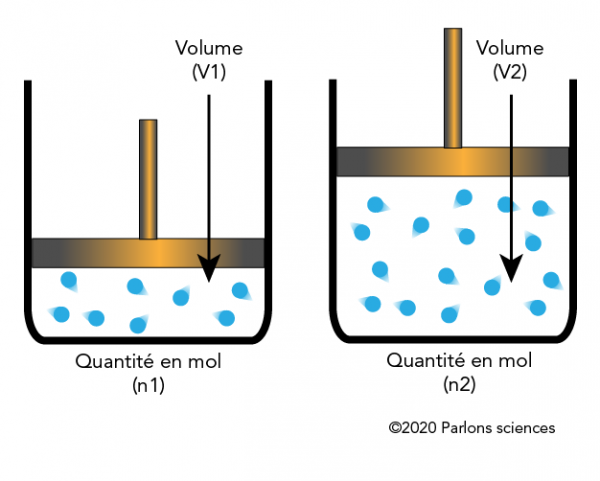
La loi d’Avogadro et la loi des gaz parfaits

Une jeune femme qui gonfle un ballon (Deagreez, iStockphoto)

Une jeune femme qui gonfle un ballon (Deagreez, iStockphoto)
11
Quels sont les liens avec mon programme d'études?
AB
8
Connaissances et employabilité Sciences, 8e et 9e années (2007)
Unité A: Mélanges et circulation de la matière
AB
8
Sciences 7e, 8e et 9e années Programme d'études (Révision 2014)
Unité A: Mélanges et circulation de la matière
NS
8
Sciences 8e année (2020-21)
Les apprenants mettront à l'essai les effets des changements de température et de pression sur les propriétés des fluides.
NU
8
Connaissances et employabilité Sciences, 8e années (Alberta, 2007)
Unité A: Mélanges et circulation de la matière