Les équations chimiques

Main de quelqu’un écrivant des équations chimiques (Igor Kutyaev, iStockphoto).

Main de quelqu’un écrivant des équations chimiques (Igor Kutyaev, iStockphoto).
Quels sont les liens avec mon programme d'études?
Apprends comment écrire et équilibrer des équations chimiques.
Tu as sans doute déjà entendu le mot équation. C’était probablement dans un cours de mathématiques plutôt qu’en sciences, par contre. Une équation est un énoncé mathématique comportant un signe d’égalité. Cela signifie que ce qui se trouve à gauche du signe d’égalité est égal à ce qui est à droite du « = ».
Une équation chimique est une façon de représenter une réaction chimique. Les réactifs sont indiqués du côté gauche, et les produits, du côté droit. Au lieu d’un signe d’égalité, une flèche est dessinée entre les réactifs et les produits. Il est important de noter que la flèche ne signifie pas la même chose qu’un signe d’égalité. La flèche indique que les réactifs sont convertis en produits. La forme générale d’une équation chimique ressemble à ceci :
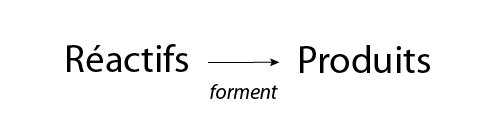
Image - Version textuelle
L'image montre une formule chimique générale utilisant des mots. À gauche, on trouve le mot " réactifs " , puis une flèche pointant vers la droite et le mot " produits ". Sous la flèche, on trouve le mot "forment". Si l'on considère cette formule comme une phrase, on obtient "les réactifs forment les produits".
Une équation chimique contient des informations importantes sur la réaction. La première information est la formule chimique de chacun des produits et réactifs. Une formule chimique représente le nombre d’éléments différents qui composent une. Tu connais peut-être certaines des formules chimiques populaires suivantes.
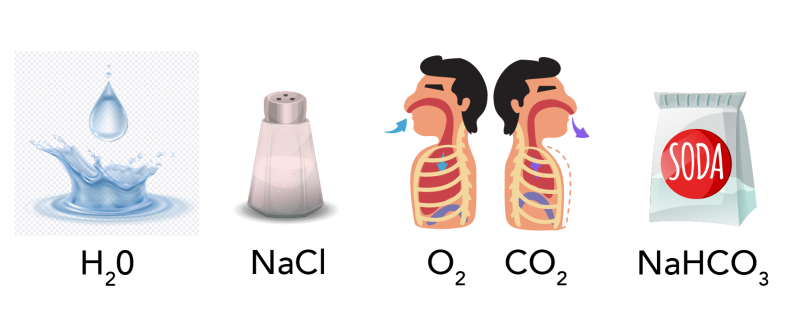
Version textuelle
Voici quatre illustrations et les formules chimiques de certaines molécules courantes.
À l'extrême gauche se trouve l'image d'une goutte d'eau, en dessous se trouve la formule H2O.
À droite, vous trouverez l'illustration d'une salière à moitié pleine de sel. En dessous se trouve la formule NaCl.
À droite de cette image, deux image de torse humain, avec le système respiratoire visible. Dans l'image de gauche, une flèche pointe vers la bouche, indiquant que la personne inhale. Sous cette image figure la formule O2. Sur l'image de droite, une flèche pointe vers l'extérieur de la bouche, indiquant que la personne expire. Sous cette image se trouve la formule CO2.
L'image la plus à droite représente un sac en papier blanc. Il porte une grande étiquette avec le texte "soda" pour indiquer qu'il s'agit d'un sac de bicarbonate de soude. En dessous se trouve la formule NaHCO3.
Le savais-tu?
Le tableau périodique énumère tous les éléments existants. Mais dans la nature, ces éléments existent rarement sous forme d’atomes uniques. Par exemple, les molécules d’oxygène ont tendance à s’associer dans l’air. C’est pourquoi la formule chimique de l’oxygène atmosphérique est O2. Elle représente deux atomes d’oxygène reliés entre eux.
Équations squelettes
Une équation squelette est la forme simple d’une réaction chimique. Elle comprend les formules chimiques, avec un « + » entre chaque formule chimique. Ici, A et B sont les formules chimiques des réactifs. C et D sont les formules chimiques des produits.
La forme générale d’une équation squelette est :
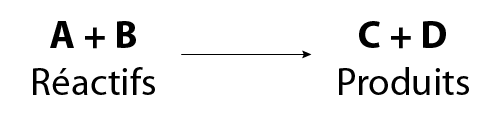
Version textuelle
Voici la forme générale de l'écriture d'une équation squelettique.
À gauche, on trouve le texte "A + B", identifiés "Réactifs" en-dessous. Puis une flèche pointant vers la droite mène vers le texte "C + D" et dessous identifiés "Produits". La flèche indique que la réaction se déroule vers la droite.
Les équations squelettes peuvent également fournir des indicateurs de phase. Ces indicateurs précisent dans quelle phase, aussi appelée état, se trouve un produit chimique donné. Ces phases peuvent être solide (s), liquide (l), gazeuse (g) et aqueuse (aq). La phase aqueuse est un état dans lequel quelque chose est dissous dans l’eau.
Voici un exemple utilisant la réaction classique du bicarbonate de soude avec du vinaigre (acide acétique). Les réactifs sont le bicarbonate de soude solide et l’acide acétique aqueux. Les produits sont le dioxyde de carbone gazeux, l’eau liquide ainsi que les sodium (Na+) et acétate (CH3COO–) dissous.

Image - Version textuelle
L'équation squelette illustrée montre la réaction entre le bicarbonate de sodium solide et une solution aqueuse de vinage, aussi appelée acide acétique qui forme du dioxyde de carbone gazeux, de l'eau liquide, et dissous dans l’eau, des ions de sodium positifs et des ions acétate négatifs.
L'équation squelette, de gauche à droite, montre que le NaHCO3 solide se combine avec le CH3COOH aqueux pour former du CO2 gazeux, du H2O liquide, des ions Na+ et des ions CH3COO-.
Sous la formule NaHCO3 se trouve l'illustration d'un sac avec l'étiquette "soda" indiquant qu'il s'agit de bicarbonate de soude. Sous la formule CH3COOH se trouve l'illustration d'une bouteille en verre remplie d'un liquide clair. Cette illustration représente l'acide acétique, ou vinaigre. Sous la formule CO2 se trouve l'illustration de bulles. Ces bulles représentent le gaz carbonique. Sous les formules H2O, Na+ CH3COO- se trouve l'illustration d'un bol en verre contenant un liquide clair. Ce liquide représente une solution aqueuse contenant des ions sodium et des ions acétate.
Le savais-tu?
Le vinaigre se compose d’acide acétique (CH3COOH), d’eau et de traces d’autres produits chimiques, qui peuvent inclure des arômes.
Réactions réversibles et équilibre dynamique
En général, les réactions chimiques convertissent les réactifs en produits. Dans certains cas, il est possible d’inverser une réaction chimique. C’est ce qu’on appelle une réaction réversible. Un exemple de réaction réversible se produit dans les piles rechargeables. Dans les piles ordinaires, une fois que tous les produits chimiques dans la pile ont été utilisés, les piles sont « mortes ». Les piles rechargeables utilisent l’énergie électrique pour transformer les produits en réactifs d’origine.

Image - Version textuelle
Photographie en couleur de trois batteries rechargeables dans un chargeur. Les étiquettes sur les piles sont partiellement visibles, montrant l'icône de la borne positive et le texte Ni-MH, qui indique que les batteries contiennent du nickel et un hydrure métallique. Une partie du texte "rechargeable" est également visible.
Parfois, dans une réaction réversible, les deux côtés de la réaction peuvent se produire en même temps. Dans ce cas, la réaction atteint un point d’équilibre où la vitesse de la réaction directe (vers l’avant/la droite) est égale à la vitesse de la réaction inverse (vers l’arrière/la gauche). C’est ce qu’on appelle un équilibre dynamique.
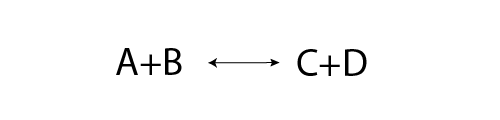
Image - Version textuelle
L'équation squelette d'une réaction réversible est illustrée.
À gauche, on trouve le texte "A + B" et à droite, le texte "C + D". Entre les deux côtés se trouve une flèche avec des points aux deux extrémités. Cette flèche indique que la réaction directe de A + B se déroule en même temps que la réaction inverse de C + D.
Parfois, un mot ou un symbole est ajouté au-dessus de la flèche. Il indique les conditions nécessaires pour qu’une réaction soit possible. Cela comprend le besoin de choses comme un courant électrique, la chaleur, la haute pression, la lumière ou un catalyseur. Voici un exemple d’équation qui nécessite de la chaleur. Le symbole du triangle, appelé delta, indique que de la chaleur est nécessaire.
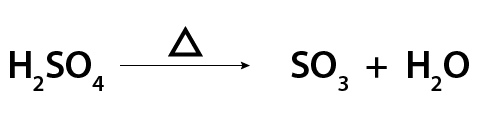
Image - Version textuelle
L'illustration montre une équation chimique pour la décomposition de l'acide sulfurique en présence de chaleur. Sur le côté gauche se trouve la formule chimique de l'acide sulfurique, H2SO4. Puis une flèche pointe vers la droite, indiquant que la réaction se déroule vers la droite. Au-dessus de la flèche se trouve le symbole d'un triangle. Cela indique que la chaleur est nécessaire pour que cette réaction se produise. À droite de l'équation figurent les formules chimiques du trioxyde de soufre, SO3, et de l'eau, H2O.
Équations chimiques équilibrées
Tout comme notre squelette forme la structure de notre corps, les diagrammes squelettes forment la structure des équations chimiques. Mais le corps ne se résume pas au seul squelette! Les équations chimiques sont également plus complexes.
L’information la plus importante qui manque dans une équation squelette est la quantité de réactifs et de produits impliqués dans la réaction. Une équation chimique équilibrée contient ces informations additionnelles. Contrairement aux équations squelettes, les équations équilibrées sont ajustées de sorte que la Loi de la conservation de la masse soit respectée. Cela signifie que la masse ne peut être ni créée ni détruite. Pour en savoir plus à ce sujet, voir la vidéo ci-dessous.
Dans une équation chimique équilibrée, nous indiquons les quantités à l’aide de coefficients. Un coefficient est un nombre (habituellement un nombre entier) qui est placé devant une formule chimique. Les coefficients représentent le rapport relatif entre les différents produits chimiques impliqués dans la réaction. La forme générale d’une équation chimique équilibrée est présentée ci-dessous.
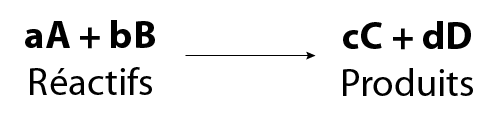
Image - Version textuelle
Voici la forme générale pour écrire une équation squelette avec des coefficients.
À gauche, on trouve le texte "a minuscule devant A majuscule + b minuscule devant B majuscule". En dessous se trouve le mot "Réactifs". À droite, on trouve le texte "c minuscule devant C majuscule + d minuscule devant D majuscule ". En dessous se trouve le mot "Produits". Entre les deux côtés se trouve une flèche pointant de gauche à droite. Cette flèche indique que la réaction se déroule vers la droite.
Prenons un exemple simple. Voici l’équation squelette et l’équation équilibrée pour l’hydrolyse de l’eau. Cette réaction consiste à décomposer les molécules d’eau en utilisant de l’électricité.
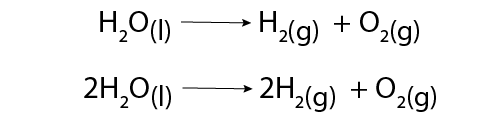
Image - Version textuelle
Deux équations chimiques sont représentées.
Dans l'équation du haut, une molécule de H2O se décompose pour former une molécule de H2 et une molécule de O2. Ceci est indiqué par une flèche vers la droite. Dans cette réaction, l'eau liquide forme de l’hydrogène et de l’oxygène gazeux. Cette équation est considérée comme une équation chimique déséquilibrée car le nombre d'atomes de chaque élément de chaque côté de l'équation n'est pas égal.
Dans l'équation du bas, deux molécules de H2O se décomposent pour former deux molécules de H2 et une molécule de O2. Ceci est indiqué par une flèche vers la droite. Dans cette réaction, l'eau liquide forme de l’hydrogène et de l’oxygène gazeux. On considère qu'il s'agit d'une équation chimique équilibrée puisque le nombre d'atomes de chaque élément de chaque côté de l'équation est égal.
Tu te demandes peut-être pourquoi deux molécules d’hydrogène (2H2) sont nécessaires plutôt qu’une. Pour qu’une équation chimique soit équilibrée, le nombre d’atomes du côté gauche d’une équation chimique doit être égal au nombre d’atomes du côté droit de l’équation.
Nous avons commencé avec H2(g) + O2(g) du côté droit de l’équation. Cela signifie qu’il y a deux atomes d’hydrogène (H2) et deux atomes d’oxygène (O2) :
H2(g) + O2(g)
Nous savons que l’eau est composée de deux atomes d’hydrogène (H2) et d’un seul atome d’oxygène (O) :
H2O(l)
Cela nous donnerait :
H2O(l )→ H2(g) + O2(g)
Si on compte les atomes de chaque côté, on voit qu’il y a deux atomes d’hydrogène à gauche et deux à droite – c’est équilibré. Cependant, il y a deux atomes d’oxygène à droite, mais un seul à gauche. D’une certaine manière, nous devons faire en sorte que le nombre de molécules d’oxygène soit le même de chaque côté. Si nous doublons le nombre d’atomes d’oxygène à gauche en doublant le nombre de molécules d’eau, nous aurions alors :
2H2O
Le deux devant signifie que si nous avons deux molécules d’eau, il y aurait quatre atomes d’hydrogène et deux atomes d’oxygène.
Mais nous avons maintenant quatre atomes d’hydrogène à gauche (2H2), mais seulement deux atomes à droite (H2)! Comment faire pour que les deux côtés soient égaux? C’est simple, nous doublons le nombre de H2 à droite, ce qui nous donne finalement :
2H2O(l )→ 2H2(g) + O2(g)
Dans cette réaction, il y a quatre atomes d’hydrogène et deux atomes d’oxygène tant dans le réactif que dans les produits.
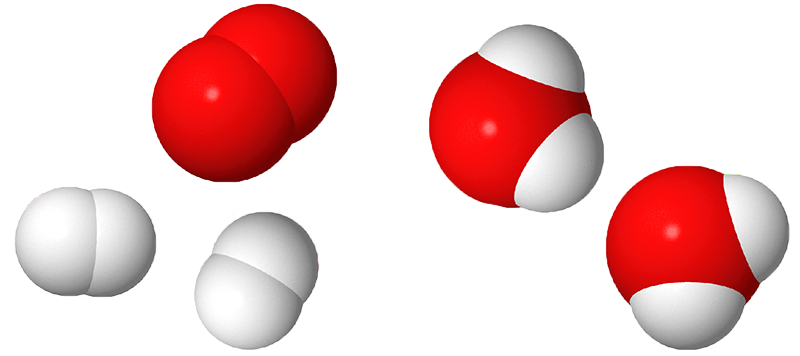
Image - Version textuelle
L'image montre des images 3D de molécules d'hydrogène, d'oxygène et d'eau. L'hydrogène est représenté par des sphères blanches et l'oxygène par des sphères rouges.
On voit sur l’image une molécules de dioxygène composée de deux sphères rouges collées ensemble. Il y a aussi deux molécules de dihydrogène, chacune composées de deux sphères blanches collées ensemble. Ensuite, une flèche pointe vers deux molécules d’eau, chacune formées d’une sphère rouge, l’oxygène et deux sphères blanches, d’hydrogène.
Il est important de se rappeler que le nombre qui est petit et en indice (sous la ligne) ne fait référence qu’au symbole qui le précède immédiatement. Un coefficient s’applique à TOUS les symboles qui suivent, y compris les petits nombres indicés.
À ton tour maintenant!
Question 1 : Comment équilibrerais-tu les réactifs et le produit dans la réaction suivante?
N2 + O2 → NO
Question 2 : Comment équilibrerais-tu le réactif et les produits dans la réaction suivante du peroxyde d’hydrogène (H2O2) formant de l’eau et de l’oxygène gazeux?
H2O2 → H2O + O2
Question 3 : Comment équilibrerais-tu les réactifs et les produits dans la réaction de combustion suivante entre le propane (C3H8), qui est utilisé dans les barbecues, et l’oxygène (O2)?
C3H8 (g) + O2(g) → CO2(g) + H2O (g) +
chaleur et lumière
Réponses
Question 1 : Comment équilibrerais-tu les réactifs et le produit dans la réaction suivante?
Une bonne façon de résoudre ce problème est de créer un inventaire des atomes de chaque élément de chaque côté.
| Élément | Réactifs | Produit |
| N | 2 | 1 |
| O | 2 | 1 |
Généralement, pour équilibrer des équations, tu commences par les éléments autres que l’oxygène et l’hydrogène. C’est simplement parce que ce sont habituellement les atomes les plus abondants et qu’il est préférable de les équilibrer à la fin. Si tu doubles le nombre de NO dans le produit, tu obtiens :
| Élément | Réactifs | Produit |
| N | 2 | 2 |
| O | 2 | 2 |
N2 + O2 → 2NO
L’équation est maintenant équilibrée. Il y a deux atomes d’azote et deux atomes d’oxygène de chaque côté de l’équation.
Question 2 : Comment équilibrerais-tu le réactif et les produits dans la réaction suivante du peroxyde d’hydrogène (H2O2) se décomposant en eau et en oxygène gazeux?
H2O2 → H2O + O2
Fais d’abord l’inventaire des atomes.
| Élément | Réactif | Produits |
| O | 2 | 3 |
| H | 2 | 2 |
Comme l’oxygène du côté des réactifs se trouve cette fois dans deux molécules différentes, nous n’avons pas besoin de changer les deux. Nous pouvons simplement changer le H2O du côté des produits. Si nous doublons le H2O, nous obtenons :
| Élément | Réactif | Produits |
| O | 2 | 4 |
| H | 2 | 4 |
H2O2 → 2H2O + O2
Pour équilibrer le côté gauche, nous avons simplement besoin de doubler le H2O2.
| Élément | Réactif | Produits |
| O | 4 | 4 |
| H | 4 | 4 |
2H2O2 → 2H2O + O2
Question 3 : Comment équilibrerais-tu les réactifs et les produits dans la réaction de combustion suivante entre le propane (C3H8), qui est utilisé dans les barbecues, et l’oxygène (O2)?
Fais d’abord l’inventaire des atomes.
| Élément | Réactifs | Produits |
| C | 3 | 1 |
| H | 8 | 2 |
| O | 2 | 3 |
Commençons par équilibrer les carbones. Pour cela, il faudrait tripler le nombre de carbones du côté droit pour obtenir :
| Élément | Réactifs | Produits |
| C | 3 | 3 |
| H | 8 | 2 |
| O | 2 | 7 |
C3H8 (g) + O2(g) → 3CO2(g) + H2O
Ensuite, multiplions l’eau du côté droit par quatre pour équilibrer l’hydrogène.
| Élément | Réactifs | Produits |
| C | 3 | 3 |
| H | 8 | 8 |
| O | 2 | 10 |
C3H8 (g) + O2(g) → 3CO2(g) + 4H2O
Enfin, multiplie l’oxygène du côté gauche par cinq pour équilibrer l’oxygène, et voilà, c’est fait!
| Élément | Réactifs | Produits |
| C | 3 | 3 |
| H | 8 | 8 |
| O | 10 | 10 |
C3H8 (g) + 5O2(g) → 3CO2(g) + 4H2O
En savoir plus
Les conditions et la vitesse des réactions chimiques
Cet article de Parlons sciences examine les conditions nécessaires pour que les réactions chimiques se produisent ainsi que leur lien avec leur vitesse, ou taux.
Le balancement d'équations chimiques ou équilibrer une équation chimique (2018)
Cette vidéo (5 min. 23 s.) d’Alloprof démontre comment balancer une équation chimique.
Équilibrer des équations chimiques
Cette page de Khan Académie présente des exercices pour pratiquer le balancement d’équations chimiques.
Types de réactions chimiques
Cet article de Parlons sciences présente les principaux types de réactions chimiques.
Les preuves d’un changement chimique
Cet article de Parlons sciences présente ce qui peut être observé lorsque des réactions chimiques se produisent.
Références
Writing and Balancing Chemical Equations (n.d.) Chemistry. Retrieved from https://opentextbc.ca/chemistry/chapter/4-1-writing-and-balancing-chemical-equations/