Introduction au tableau périodique des éléments
Le tableau périodique et un modèle moléculaire (OntheRunPhoto, iStockphoto)

Le tableau périodique et un modèle moléculaire (OntheRunPhoto, iStockphoto)
Quels sont les liens avec mon programme d'études?
Découvre les éléments du tableau périodique et la façon dont ils sont organisés.
Les éléments
On appelle élément la matière qui est composée d’un seul type d’atome. Certains éléments comme l’or, l’argent, le fer, le mercure et l’étain sont connus depuis des centaines d’années. Au cours des 18e et 19e siècles, les scientifiques en ont découvert de nombreux autres. Certains des éléments ont même été découverts au cours de ta vie!
Nommer les éléments
La plupart des noms et des symboles des éléments proviennent du latin ou du grec. Par exemple :
| Élément | Symbole atomique | Origine du mot |
|---|---|---|
| Or | Au | Mot latin Aurum qui signifie « aurore lumineuse » |
| Mercure | Hg | Mot grec Hydrargyrum qui signifie « argent liquide » |
| Chlore | Cl | Mot grec Chloros qui signifie « vert » |
| Néon | Ne | Mot grec Neos qui signifie « nouveau » ou « différent » |
Certains noms proviennent aussi de scientifiques célèbres comme :
| Élément | Symbole atomique | Origine du mot |
|---|---|---|
| Curium | Cm | Pierre et Marie Curie (recherche sur la radioactivité) |
| Einsteinium | Es | Albert Einstein |
| Nobélium | No | Alfred Nobel (célèbre pour la création du prix Nobel) |
| Mendélévium | Md | Dmitri Mendeleïev (créateur du premier tableau périodique) |
D’autres éléments tirent leur nom de lieu, comme :
| Élément | Symbole atomique | Origine du mot |
|---|---|---|
| Europium | Eu | Europe |
| Francium | Fr | France |
| Germanium | Ge | Allemagne |
| Berkélium | Bk | Berkeley, Californie, États-Unis |
| Dubnium | Db | Dubna, Russie |
Le savais-tu?
L’Argentine tire son nom d’un élément. Son nom lui vient du mot latin argent, Argentum, car les Premières Nations avaient offert de l’argent en cadeau aux premiers conquérants européens.
Le tableau périodique des éléments
Le tableau périodique des éléments consiste en un moyen visuel et logique d’organiser tous les éléments. De façon générale, on attribue la création du premier tableau périodique, en 1869, au scientifique russe Dmitri Mendeleïev. En Allemagne, plus tard dans la même année, Lothar Meyer a aussi créé un tableau presque identique. Certaines personnes attribuent la première classification à Alexandre-Emile Béguyer de Chancourtois.

Le tableau périodique répertorie chaque élément dans une case en donnant son symbole atomique et son numéro atomique. Parfois, le nom complet de l’élément et sa masse atomique sont aussi indiqués. L’image ci-dessous présente une entrée typique pour le calcium.

Le nombre au-dessus du symbole atomique représente le numéro atomique. Le numéro atomique est égal au nombre de protons du noyau de l’atome et détermine quel élément est l’atome. Par exemple, tout atome possédant exactement 20 protons dans son noyau est un atome de calcium. Le nombre de protons influence le comportement chimique d’un élément.
La masse atomique d’un élément fait référence à la masse d’un élément exprimée en unité de masse atomique (u). De manière générale, on retrouve cette information au bas de la case d’un élément dans le tableau périodique. On exprime la masse atomique en nombre décimal, car il s’agit d’une moyenne des masses des divers isotopes d’un élément. Les isotopes d’un élément possèdent le même nombre de protons, mais diffèrent par leur nombre de neutrons. Par exemple, l’hydrogène possède trois isotopes naturels. L’isotope le plus commun, le protium, ne possède pas de neutrons! Le deutérium possède un neutron et le tritium en possède deux.
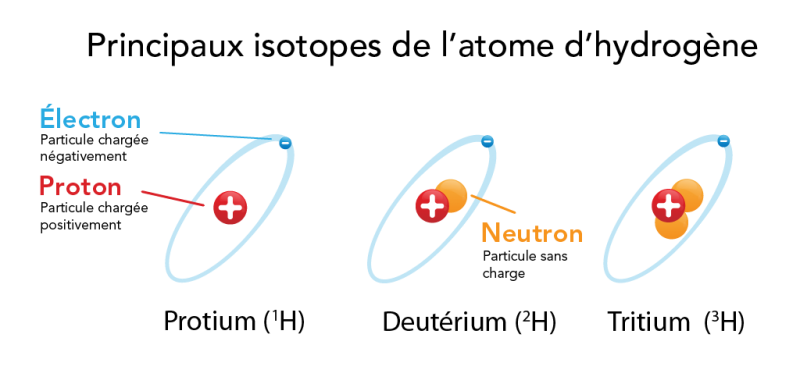
Les scientifiques ont également créé d’autres isotopes hautement instables de l’hydrogène. Ces derniers, qui possèdent jusqu’à 7 neutrons, n’existent pas dans la nature.
On peut facilement connaître le nombre moyen de neutrons d’un élément. Il suffit de soustraire le nombre de protons (numéro atomique) de la masse atomique. Par exemple, le numéro atomique du calcium est de 20 et sa masse atomique est de 40,078 u. En soustrayant 20 de 40 (une fois le nombre arrondi), nous pouvons déterminer que le nombre moyen de neutrons est de 20.
La classification des éléments
Mendeleïev a organisé le tableau périodique en fonction de la masse atomique des éléments, de la plus petite à la plus grande. Ensuite, il a défini des lignes horizontales et verticales (ou colonnes) pour mettre en évidence les éléments qui possèdent des propriétés chimiques similaires. Les lignes horizontales sont appelées périodes. Tous les éléments d’une même période possèdent le même nombre de couches électroniques. Les colonnes sont appelées groupes (ou familles).
Mendeleïev a également laissé quelques espaces vides dans son tableau. Il croyait que certains éléments n’avaient pas encore été découverts. Ces espaces vides étaient destinés à des éléments non découverts. Mendeleïev s’attendait à ce que des éléments manquants aient les mêmes propriétés que les autres éléments de la même colonne.
Au cours des années 1990, de nombreuses découvertes ont mené à de nouveaux éléments. Le tableau de Mendeleïev a été adapté pour en arriver au modèle que nous utilisons aujourd’hui. Le tableau moderne inclut encore aujourd’hui les principes des familles et des périodes.
Les groupes du tableau périodique sont numérotés de 1 à 18. Les éléments d’un même groupe possèdent généralement des propriétés similaires. Par exemple, les éléments du groupe 18 sont tous des gaz qui ne réagissent pas facilement avec d’autres éléments. Certains groupes possèdent parfois un nom. Par exemple, les éléments du groupe 18 sont appelés « gaz nobles ».
Le savais-tu?
Les gaz nobles sont nommés de la sorte en raison de leur capacité à ne pas réagir avec d’autres éléments. Comme les humains qui gardent leur calme et sont considérés nobles.

À l’exception de l’hydrogène, les éléments du côté gauche du tableau périodique sont des métaux. À température ambiante, les métaux sont solides, à l’exception du mercure, qui est liquide. Les métaux sont aussi malléables et extensibles. C’est-à-dire qu’ils peuvent être formés. Les métaux ont aussi un aspect brillant. Ils sont de bons conducteurs de chaleur et d’électricité.
Les éléments du côté droit du tableau périodique sont des non-métaux. À température ambiante, les non-métaux peuvent être solides, liquides ou gazeux. Ils sont de mauvais conducteurs de chaleur et d’électricité.
Les éléments qui possèdent certaines propriétés métalliques et non métalliques sont appelés métalloïdes (par exemple, le silicium, l’arsenic, etc.).
Parfois, nous appelons les éléments des groupes 3 à 12 le bloc d. Ces éléments sont aussi connus sous le nom d’éléments de transition.
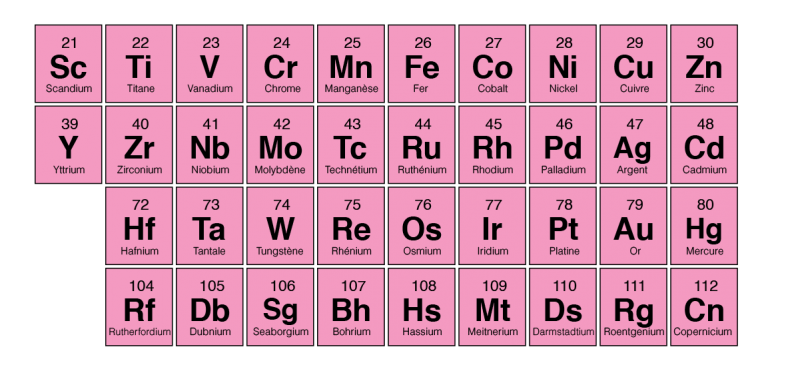
Au bas du tableau périodique, on retrouve deux rangées. Ce sont les lanthanides et les actinides. Les lanthanides sont quinze éléments métalliques qui ont un numéro atomique entre 57 et 71. Les éléments lanthanides, ainsi que les deux éléments du groupe 3, le scandium et l’yttrium, sont souvent appelés les éléments des terres rares. Les lanthanides se retrouvent naturellement sur Terre. Les actinides sont bien différents. Tous les éléments actinides sont radioactifs et certains ne se trouvent pas dans la nature. Certains des éléments ayant un numéro atomique élevé peuvent uniquement être créés en laboratoire.

Les tendances du tableau périodique
Dans un groupe, du haut vers le bas, la taille ou le rayon d’un atome augmente. Les éléments ont plus de couches d’électrons, ce qui donne des atomes plus gros. Dans une période, de gauche à droite, la taille de l’atome diminue. Une plus grande quantité de protons tirent les électrons vers le noyau.
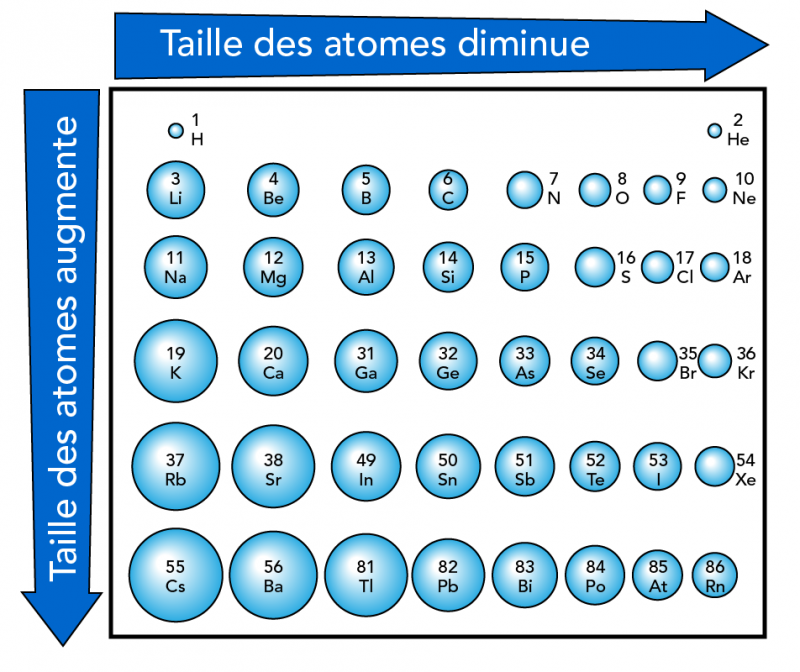
L’électronégativité est la propriété chimique qui décrit la tendance d’un atome à former des liaisons avec les autres. De manière générale, du haut vers le bas, l’électronégativité diminue au sein d’une famille et augmente, de gauche à droite, dans une période. Les éléments ayant la plus forte électronégativité se trouvent dans la partie supérieure droite du tableau (à l’exception des gaz nobles). Cela est dû au fait que les non-métaux ont une importante électronégativité. Ils ont tendance à attirer les électrons des autres atomes. Tandis que les métaux ont tendance à perdre facilement des électrons.
Attribuer des charges à un élément
Les atomes stables doivent perdre ou gagner des électrons pour être chargés électriquement. Il existe deux types de charges électriques. On retrouve les charges positives (+) et les charges négatives (-). Les substances qui possèdent la même charge se repoussent les unes les autres. Tandis que les substances ayant des charges opposées s’attirent mutuellement. Elles agissent comme des aimants!
Les atomes de certains éléments peuvent perdre ou gagner des électrons plus facilement que d’autres. Par exemple, les éléments du groupe 1 (Li, Na ou K) peuvent facilement perdre un électron, ce qui leur confère une charge de +1. Les éléments du groupe 17 (Cl, Br, I) peuvent facilement gagner un électron, ce qui leur donne une charge de -1. On appelle ion un atome ou une molécule qui possède une charge. Lorsqu’un atome ou une molécule possède plus d’électrons que de protons, on obtient un ion à charge négative appelé anion. Un ion qui a une charge positive, c’est-à-dire un atome ou une molécule qui possède plus de protons que d’électrons, est un cation.
Chaque groupe du tableau périodique a une charge spécifique communément associée à ses ions. Les éléments de transition, les lanthanides et les actinides sont les exceptions à cette règle. Tu trouveras ci-dessous les charges des différents groupes du tableau.
| Groupe | 1 | 2 | 3 | Éléments de transition, lanthanides et actinides | 15 | 16 | 17 | 18 |
|---|---|---|---|---|---|---|---|---|
| Charge | +1 | +2 | +3 | Variation | -3 | -2 | -1 | 0 |
Tu as peut-être remarqué que les éléments du groupe 18 ont une charge de 0. Ces éléments sont très stables et ne gagnent ou ne perdent pas facilement d’électrons.
En savoir plus
Introduction à la théorie des particules de la matière
Cet article de Parlons sciences relate l’histoire de la théorie qui illustre la matière par différents modèles de petites particules ou d’atomes.
Le tableau ingénieux créé par Mendeleïev
Cet article de Parlons sciences montre comment Dmitri Mendeleïev a créé le premier tableau périodique.
Introduction à l’atome
Cet article de Parlons sciences présente l’histoire des différents modèles atomiques créés.
Les nouveaux éléments du tableau périodique
Cet article de Parlons sciences présente les éléments les plus récents ajoutés au tableau périodique.
Références
Helmenstine, A. (2019). Introduction to the Periodic Table. Thought.co.
Webelements.com. (n.d.). The periodic table of the elements.
Western Oregon University. (n.d.). A Brief History Of The Development Of Periodic Table. People.wou.edu