Les types de réactions chimiques

Un liquide est chauffé au-dessus d’une flamme dans un laboratoire (AtnoYdur, iStockphoto)

Un liquide est chauffé au-dessus d’une flamme dans un laboratoire (AtnoYdur, iStockphoto)
Quels sont les liens avec mon programme d'études?
Ce document te renseignera sur les quatre principaux types de réactions chimiques.
Des réactions chimiques se produisent autour de nous, et même en nous, tous les jours. Il y a tellement de réactions chimiques différentes que les scientifiques trouvent utile de les regrouper en catégories pour les classer. On compte quatre principaux types de réactions chimiques :
- Les réactions de synthèse
- Les réactions de décomposition
- Les réactions de substitution (aussi appelées « réactions de déplacement »)
- Les réactions de combustion
Mais avant d’aller plus loin, nous te recommandons de lire le document d’information sur les équations chimiques afin d’en connaître plus sur ce sujet. Cette lecture te permettra de mieux comprendre les exemples donnés ci-dessous pour expliquer les différents types de réactions.
Réactions de synthèse
Dans une réaction de synthèse, deux ou plusieurs atomes ou molécules se combinent entre eux pour former un composé. Autrement dit, deux ou plusieurs réactifs s’unissent pour former un produit. Nous pouvons utiliser le symbole A pour représenter l’un des réactifs et le symbole B pour représenter l’autre réactif. Dans une réaction de synthèse, A et B se combinent pour former AB.
L’équation générale d’une réaction de synthèse est :
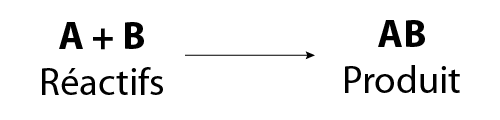
Image - Version textuelle
L'illustration montre une formule chimique générale. Dans cette formule, le réactif A se combine au réactif B pour former le produit AB.
Les propriétés physiques et chimiques de A, B et AB sont différentes. La formation d’eau (H2O) est un exemple de réaction de synthèse. Cette réaction se produit quand de l’hydrogène gazeux (H2) réagit avec de l’oxygène gazeux (O2). Le produit de cette réaction est de l’eau liquide.
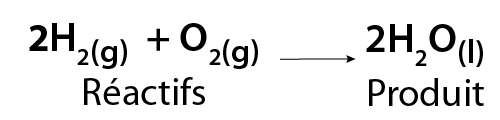
Image - Version textuelle
L'illustration montre une équation chimique. Dans cette équation, deux molécules d'hydrogène gazeux (2H2) se combinent avec une molécule d'oxygène gazeux (O2) pour former deux molécules d'eau liquide (2H2O).
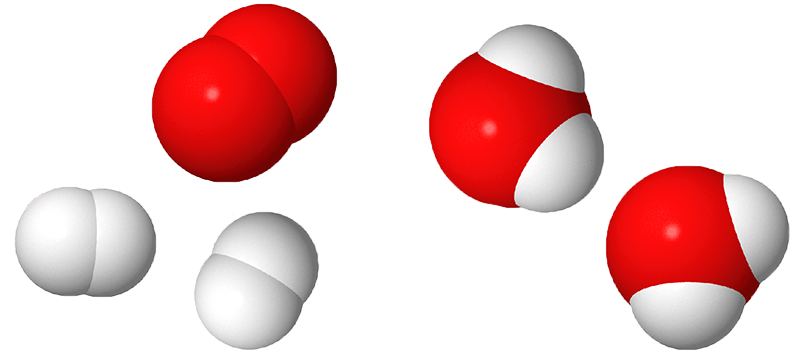
Image - Version textuelle
L'image montre des images 3D de molécules d'hydrogène, d'oxygène et d'eau. L'hydrogène est représenté par des sphères blanches et l'oxygène par des sphères rouges.
On voit sur l’image une molécules de dioxygène composée de deux sphères rouges collées ensemble. Il y a aussi deux molécules de dihydrogène, chacune composées de deux sphères blanches collées ensemble. Ensuite, une flèche pointe vers deux molécules d’eau, chacune formées d’une sphère rouge, l’oxygène et deux sphères blanches, d’hydrogène.
Cette réaction est vraiment extraordinaire quand on y réfléchit. L’hydrogène et l’oxygène gazeux sont tous deux des gaz extrêmement combustibles, mais quand ils se combinent, ils donnent comme produit une substance qui peut éteindre les incendies!
Les réactions de synthèse ne sont pas toujours une combinaison de deux substances donnant un seul produit. Certaines réactions de synthèse ont pour résultat plus d’un produit.
La photosynthèse est l’une des réactions chimiques les plus importantes sur Terre. Elle permet aux plantes et à certains microbes de convertir l’eau et le gaz carbonique en sucre stockable et en oxygène. L’oxygène produit par les plantes est essentiel à la vie sur Terre.
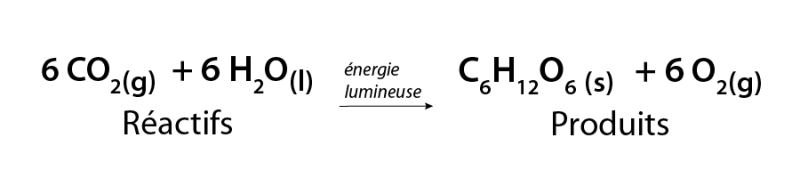
Image - Version textuelle
L'illustration montre une équation chimique. Dans cette équation, six molécules de dioxyde de carbone gazeux (6CO2) se combinent à six molécules d'eau (6H2O) en présence d'énergie lumineuse pour former une molécule de glucose (C6H12O6) et six molécules d'oxygène gazeux (6O2)
Clique sur le lien suivant pour voir une réaction de synthèse amusante parfois appelée « serpent du pharaon ». Dans cette réaction, le gluconate de calcium (C12H22CaO14) réagit avec de l’oxygène (O2) en présence d’une source de chaleur pour former de l’eau (H2O), du gaz carbonique (CO2), de l’oxyde de calcium (CaO) et du carbone (C).
Réactions de décomposition
Les réactions de décomposition sont essentiellement le contraire des réactions de synthèse. Au cours des réactions de décomposition, un composé est dissocié et devient deux ou plusieurs atomes ou molécules. Cette réaction se produit souvent quand des atomes ou des molécules sont chauffés. AB se décompose pour former A et B. Comme pour les réactions de synthèse, les propriétés physiques et chimiques de AB, A et B sont différentes.
L’équation générale d’une réaction de décomposition est :
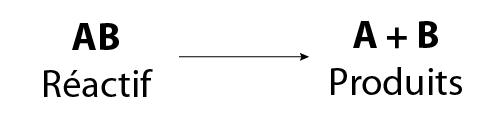
Image - Version textuelle
L'illustration montre une équation chimique générale. Dans celle-ci, le réactif AB se sépare pour former les produits A et B.
Un exemple typique de cette réaction est la décomposition de l’eau en hydrogène et oxygène gazeux. Cette réaction se produit quand un courant électrique traverse de l’eau dans un processus appelé électrolyse.
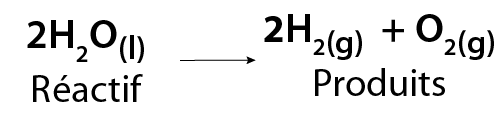
Image - Version textuelle
L'illustration montre une équation chimique. Dans celle-ci, deux molécules d'eau liquide (2H2O) se décomposent pour former deux molécules d'hydrogène gazeux (2H2) et une molécule d'oxygène gazeux (O2).
Lorsque nous cuisinons certains de nos mets préférés, comme des biscuits, une importante réaction de décomposition se produit. Le bicarbonate de sodium (aussi appelé « bicarbonate de soude ») est un ingrédient qui entre dans de nombreuses recettes. Le bicarbonate de sodium NaHCO3(s) rend les aliments tendres et moelleux. Aimerais-tu savoir ce qui se produit pour arriver à ce résultat?
Quand on place la pâte à biscuits dans le four, on ajoute de la chaleur au mélange. Quand la température de la pâte s’élève à plus de 80 °C (176 °F), le bicarbonate de sodium se décompose en carbonate de sodium (Na2CO3), en vapeur d’eau (H2O) et en gaz carbonique (CO2).

Image - Version textuelle
L'illustration montre une réaction chimique. Dans celle-ci, deux molécules de bicarbonate de sodium (2NaHCO3) se décomposent en présence de chaleur pour former une molécule de carbonate de sodium solide (Na2CO3), une molécule de dioxyde de carbone gazeux et une molécule de vapeur d'eau.
Le savais-tu?
Le carbonate de sodium est également connu sous le nom de « cendre de soude ». Tu peux en apprendre davantage au sujet de la cendre de soude dans ce document d’information.

Image - Version textuelle
La photo en couleur montre un plateau de biscuits sur une plaque dans un four. Les biscuits sont dorés et prêts à être mangés.
Les bulles de gaz carbonique sont emprisonnées dans le mélange de farine à mesure qu’il durcit, ce qui donne des biscuits moelleux comme on les aime!
Réactions de substitution
Comme son nom l’indique, la réaction de substitution est une réaction au cours de laquelle un élément remplace un autre élément. Il y a deux types de réactions de substitution : les réactions de substitution simple et les réactions de double substitution.
Réactions de substitution simple
Au cours d’une réaction de substitution simple, un seul élément libre C remplace un des éléments dans un composé AB. Dans ce cas, deux réactifs donnent deux produits.
L’équation générale d’une réaction de substitution simple est :
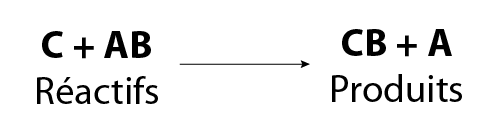
Image - Version textuelle
L'illustration montre une équation chimique générale. Dans cette équation, le réactif C se combine au réactif AB pour former le produit CB et le produit A.
La réaction explosive qui se produit quand le potassium réagit avec l’eau est un exemple de réaction de substitution simple.
Au cours de cette réaction, le potassium (K) réagit avec l’eau (H2O). Cette réaction produit de l’hydrogène gazeux et de l’hydroxyde de potassium (KOH) solide en solution aqueuse.
L’équation de la réaction entre le potassium et l’eau est :
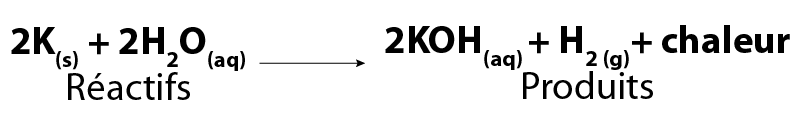
Image - Version textuelle
Dans cette formule chimique, deux molécules de potassium solide (2K) réagissent avec deux molécules d'eau liquide (2H2O) pour former deux molécules d'hydroxyde de potassium (2KOH) en solution et une molécule d'hydrogène gazeux (H2). La réaction libère également de l'énergie sous forme de chaleur.
La réaction qui se produit entre le potassium et l’eau libère aussi de l’énergie sous forme de chaleur. On dit alors qu’il s’agit d’une réaction exothermique. Une deuxième réaction se produit peu de temps après la production d’hydrogène gazeux. La chaleur libérée par la réaction entre le potassium et l’eau entraîne la combustion de l’hydrogène gazeux (tu en apprendras davantage plus loin sur les réactions de combustion).
Réactions de double substitution
Maintenant que tu sais ce qui se produit au cours d’une réaction de substitution simple, as-tu une idée de ce qui se passe au cours d’une réaction de double substitution? Si tu as répondu que deux éléments étaient remplacés, tu as raison!
Au cours d’une réaction de double substitution, deux composés réactifs forment deux nouveaux composés en échangeant des ions. Un ion est un atome ou un groupe d’atomes qui porte une charge électrique. Les cations sont des ions positifs (+) et les anions sont des ions négatifs (-). Les cations ne peuvent remplacer que d’autres cations et les anions ne peuvent remplacer que d’autres anions.
La formule générale d’une réaction de double substitution est :
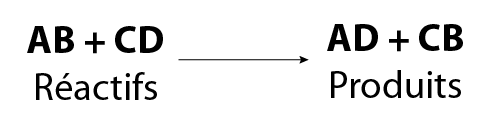
Image - Version textuelle
L'illustration montre une formule chimique générale. Dans cette formule, le réactif B remplace le réactif D et le réactif A remplace le réactif C.
Dans l’équation ci-dessus, A et C représentent les cations, tandis que B et D sont les anions. Par conséquent, C ne peut être remplacé que par A, et D ne peut être remplacé que par B.
Les réactions de double substitution les plus connues et les plus courantes sont les réactions qui mettent en jeu un acide et une base.
Réactions acide-base
Une réaction acide-base ou acidobasique est un type particulier de réactions de double substitution qui se produit entre un acide et une base. Les acides sont des substances qui se rapprochent du zéro sur l'échelle des pH. Les aliments acides ont un goût sur, aigre ou amer. Le vinaigre et le jus de citron sont deux exemples d’aliments acides. Les bases sont des substances qui se situent plus près du chiffre 14 sur l’échelle des pH. Les produits nettoyants, comme l’eau de javel et les détergents, sont les bases les plus couramment utilisées.
Le savais-tu?
Les valeurs qui se trouvent sur l’échelle des pH indiquent la quantité d’ions H+ présents dans une solution. Clique sur ce lien pour faire une activité pratique sur les acides et les bases.
Règle générale, les réactions acide-base ont pour résultat la formation d’un précipité.
Les acides et les bases ont une relation unique et intéressante. Quand ils réagissent ensemble, chaque élément a la capacité d’annuler, ou de neutraliser, les propriétés acides ou basiques de l’autre élément. C’est pourquoi les réactions acide-base sont aussi appelées des réactions de neutralisation.
Dans un grand nombre de réactions de neutralisation, un ion d’hydrogène positif (H+) réagit avec un ion d’hydroxyde négatif (OH-) en formant de l’eau (H2O).
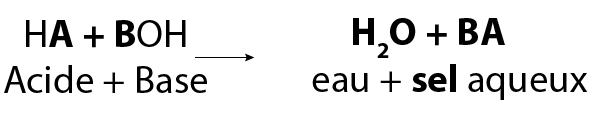
Image - Version textuelle
L'image montre une formule chimique générale. Dans cette formule, un acide HA réagit avec une base BOH pour former de l'eau (H2O) et un sel aqueux BA.
Il est important de remarquer que le mot « sel » est un terme générique qui s’applique aux produits de toutes les réactions acide-base. Ce type de réactions peut produire du sel comme celui que nous ajoutons à nos aliments. On peut en effet produire du chlorure de sodium, mieux connu sous le nom de « sel de table », en faisant réagir de l’acide chlorhydrique et de l’hydroxyde de sodium.
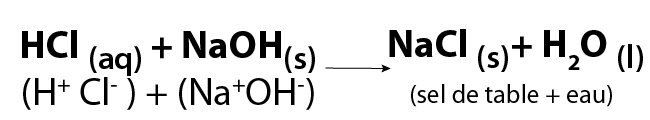
Image - Version textuelle
Dans cette formule chimique, l'acide chlorhydrique aqueux (HCl) et l'hydroxyde de sodium solide (NaOH) réagissent pour former du chlorure de sodium solide (NaCl) et de l'eau liquide (H2O). Le chlorure de sodium est également identifié comme le sel de table.
Tu verras cette réaction exothermique en action dans la vidéo suivante :
Réactions de combustion
Une réaction de combustion a lieu quand de l’oxygène gazeux (O2) réagit avec certains types de composés qui sont souvent appelés des « combustibles ». Chaque fois que tu brûles quelque chose, tu causes une réaction de combustion. Les produits les plus souvent formés par les réactions de combustion sont le dioxyde de carbone et l’eau. L’eau passe alors inaperçue, car elle est produite sous sa forme gazeuse.
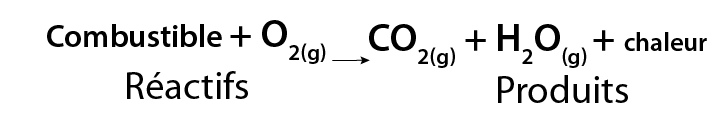
Image - Version textuelle
L'image représente une formule chimique. Dans cette formule, les réactifs sont le combustible qui se combine avec l'oxygène (O2) pour former les produits, du dioxyde de carbone (CO2), de la vapeur d'eau (H2O) et de la chaleur.
Quand un combustible provoque une réaction qui n’a pour résultat que du gaz carbonique et de l’eau, on dit qu’il s’agit d’une réaction de combustion complète.
La combustion du butane, qui est utilisé dans les briquets, est un exemple d’une combustion complète, représentée par l’équation chimique suivante :
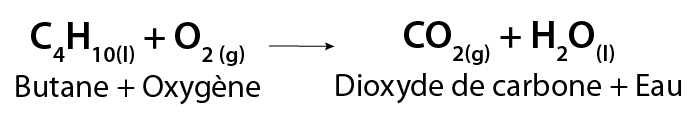
Image - Version textuelle
Dans la formule chimique illustrée, une molécule de butane (C4H10) réagit avec de l'oxygène (O2) pour former du dioxyde de carbone (CO2) et de la vapeur d'eau (H2O).
Parfois, le combustible ne réagit pas complètement. Ce type de réactions est appelé réaction de combustion incomplète. La combustion incomplète de combustibles à base de carbone donne des produits comme le monoxyde de carbone, un gaz inodore dangereux, et de la suie, composée de particules de carbone.
Voyons maintenant ce qui se produit lorsqu’une chandelle brûle.
Quand tu touches la mèche d’une chandelle avec une flamme, tu provoques une réaction de combustion. La plupart des mèches de chandelles sont faites de coton, lequel brûle facilement. En brûlant, la mèche prend l’oxygène nécessaire dans l’air. S’il n’y avait pas d’oxygène, la mèche cesserait de brûler. La chaleur produite pendant cette réaction de combustion fait fondre la cire solide et la transforme en gaz. Les minuscules molécules de cire gazeuse brûlent ensuite à leur tour lorsqu’elles entrent en contact avec l’oxygène de l’air. Les principaux produits de cette combustion sont du gaz carbonique et de la vapeur d’eau. Une quantité considérable de suie est également formée avec les atomes de carbone, ainsi qu’un peu de monoxyde de carbone (CO).

Image - Version textuelle
L'image montre la photographie d'une bougie qui brûle sur un fond noir. Des étiquettes indiquent les différentes parties de la bougie et leur température.
La partie inférieure de la bougie est identifiée comme de la cire solide. La partie supérieure de la bougie, la plus proche de la flamme, est identifiée comme de la cire fondue. Au sommet de la bougie se trouve un bout de corde verticale appelé mèche. La mèche est de la même couleur que la cire en bas et noire en haut.
Les couleurs de la flamme sont indiquées. La partie la plus basse de la flamme est bleue. Le bleu signifie la combustion complète de la cire. Cela se produit à environ 800 degrés Celsius. Cette partie de la flamme est capable de réagir avec la majorité de l’oxygène gazeux qui l’entoure.
Au-dessus de la partie bleue de la flamme se trouve la partie orange de la flamme. L'orange signifie la combustion incomplète de la cire. Cela se produit à environ 1200 degrés Celsius. Cette partie de la flamme réagit avec moins d'oxygène que la partie bleue de la flamme.
Au-dessus de la partie orange de la flamme se trouve la partie blanche jaunâtre pâle de la flamme. C'est la partie la plus brillante de la flamme. La lumière est causée par les particules de suie brûlantes. Cette région de la flamme est composée de vapeur d'eau, de dioxyde de carbone, de monoxyde de carbone et de suie (carbone). La température de la flamme dans cette région est d'environ 1000 degrés Celsius.
Juste au-dessus de la partie supérieure de la flamme, se trouve la partie la plus chaude de la flamme. Nous ne pouvons pas réellement voir cette partie. Elle a une température d'environ 1400 degrés Celsius.
La flamme d’une chandelle est un bon exemple de combustion incomplète. Les moteurs des automobiles subissent eux aussi une combustion incomplète lorsqu’ils brûlent de l’essence ou du diesel.
Le savais-tu?
Dans un environnement en microgravité, la flamme d’une chandelle est ronde parce que les gaz chauds qui sont produits ne montent pas vers le haut.
Il est important de savoir que les réactions de combustion sont des réactions exothermiques, ce qui veut dire qu’elles produisent de la chaleur. On utilise souvent les réactions de combustion pour la chaleur et la lumière que ces réactions produisent. Que ce soit en brûlant du bois pour créer un bon feu de camp, en brûlant du gaz naturel pour cuire nos aliments et chauffer nos maisons, ou qu’il s’agisse de la combustion de l’acétylène avec l’oxygène dans une torche de soudeur, les réactions de combustion jouent un rôle important dans nos vies.
En fait… TOUS les types de réactions chimiques jouent un rôle important dans nos vies!
En savoir plus
37 types de réactions chimiques
Cet article de Gérard Villemin présente une liste complète et détaillée des types de réactions chimiques.
Les réactions chimiques – Introduction (2017)
Cette vidéo (21 min. 31 s.) de Clipedia présente les types de réactions chimiques et des exemples tirés dela vie quotidienne ou des actualités.
La Combustion
Cette vidéo (7 min. 6 s.) de Mathrix présente la théorie et des exemples de combustion complète et incomplète.
Références
Candle Science (n.d.) Candles.org. Retrieved from https://candles.org/candle-science/
Combustion and Flame (n.d.) EduBeans. Retrieved from https://www.edubeans.com/Class_VIII_Science_Combustion-and-Flame.php.
Helmenstine, A.M. (2020). Types of Chemical Reactions. ThoughtCo. Retrieved from https://www.thoughtco.com/types-of-chemical-reactions-604038.
Types of Chemical Reactions. (2019, June 5). LibreTexts. Retrieved from https://chem.libretexts.org/@go/page/79224