Les conditions et la vitesse des réactions chimiques

Des appareils de galvanoplastie (Remigiusz Gora, iStockphoto)

Des appareils de galvanoplastie (Remigiusz Gora, iStockphoto)
Quels sont les liens avec mon programme d'études?
Découvre les conditions particulières qui permettent à certaines réactions chimiques de se produire.
En tout temps, des réactions chimiques se produisent sur Terre et dans l’Univers. En revanche, elles ne se produisent que sous certaines conditions. Et ce n’est pas une mauvaise chose! Par exemple, les incendies ne se produisent que lorsqu’il y a suffisamment de chaleur, d’oxygène et de combustible. Peux-tu imaginer un monde dans lequel la matière ne se décompose jamais?
Une réaction chimique implique l’interaction entre différentes substances ou matières. Ces interactions impliquent de l’énergie. L’énergie peut prendre de nombreuses formes, comme la lumière, la chaleur ou le mouvement. Nous examinerons plus attentivement la façon dont ces formes d’énergie agissent dans des réactions chimiques.
Le savais-tu?
Le mouvement est une forme d’énergie cinétique.
Les scientifiques expriment les réactions chimiques à l’aide d’équations chimiques. Dans une équation chimique, la matière est définie en termes de réactifs et de produits. L’énergie de la réaction est parfois incluse dans l’équation. Examinons certains exemples de différents types de conditions nécessaires à la production d’une réaction chimique.
Les réactions chimiques qui nécessitent de la chaleur
Une source de chaleur est nécessaire à de nombreuses réactions pour qu’elles se produisent. Nous appelons ces réactions des réactions endothermiques. La majorité des réactions endothermiques ne peuvent pas avoir lieu à une température ambiante normale. En laboratoire, les scientifiques peuvent chauffer les réactifs à l’aide d’un brûleur À la maison, tu peux chauffer les réactifs dans une casserole sur la cuisinière ou dans le four.
Le savais-tu?
Tous les jours, des gens réalisent des réactions chimiques avec de la chaleur lorsqu’ils font cuire des aliments!

Le type de réaction qui nécessite évidemment de la chaleur est la réaction de combustion. Dans la langue de tous les jours, nous employons le verbe « brûler ». Certaines réactions de combustion sont très évidentes, comme brûler du bois. D’autres réactions sont moins évidentes, comme lorsque notre corps transforme les aliments en énergie.
Le savais-tu?
En plus de nécessiter de la chaleur, les réactions de combustion ont besoin d’oxygène.
La combustion n’est pas le seul type de réaction chimique qui nécessite de la chaleur. Pense à lorsque tu fais cuire un œuf. Lorsqu’un œuf cuit, les protéines qu’il contient se décomposent avec la chaleur. Nous savons qu’il s’agit d’une réaction chimique, car les produits qui en résultent ne possèdent pas les mêmes caractéristiques que le produit initial. Un blanc d’œuf non cuit est liquide et transparent. Un blanc d’œuf cuit est solide et blanc. Cuire un œuf est un bon exemple de réaction chimique irréversible. Un œuf cuit ne peut plus redevenir un œuf cru!
Attention aux fausses idées!
Lorsque l’on chauffe des protéines, les liaisons se séparent par un processus appelé dénaturation. Les processus de dénaturation ne sont pas tous irréversibles. Il en dépend de la mesure à laquelle le produit est dénaturé. C’est le cas de la gélatine, comme le JELL-OMD. Le JELL-OMD liquide mis au réfrigérateur deviendra solide. Le JELL-OMD solide chauffé retrouvera son état liquide.
La dégradation des protéines dans les œufs cuits est un exemple de réaction de décomposition. Les réactions de décomposition se produisent lorsqu’un réactif unique se décompose en deux ou plusieurs produits plus simples. Par exemple :
AB → A + B
La décomposition du carbonate de calcium est un autre exemple de réaction de décomposition qui nécessite de la chaleur. Tu ne connais peut-être pas très bien le nom de ce composé, mais il se trouve à la base des récifs coralliens et des coquilles des mollusques et des crustacés.
Cette équation chimique simple illustre l’enjeu du réchauffement des océans. Plus l’océan se réchauffe, plus les coquillages se fragilisent. Ce phénomène peut entraîner la mort des récifs coralliens. Cette réaction libère aussi du dioxyde de carbone, ou CO2. Le CO2 est un gaz à effet de serre qui contribue également au réchauffement atmosphérique.
CaCO3 → CaO + CO2

Chaleur et vitesse de réaction
La vitesse de réaction chimique est la vitesse à laquelle les réactifs se transforment en produits. En règle générale, la chaleur accélère la vitesse d’une réaction. La chaleur affecte les molécules en accélérant leur mouvement.
Imagine une pièce bondée de gens. Plus ces gens se promènent rapidement, plus ils ont l’occasion de rencontrer des personnes en une minute. Il se produit la même chose avec les molécules dans une réaction. Plus elles se déplacent rapidement, plus elles facilitent la réaction. Le même phénomène se produit lorsque tu cuisines. Plus la température est élevée, plus les aliments cuisent rapidement. Mais cela ne t’assure pas forcément un repas réussi!
Les réactions qui nécessitent de la lumière
La lumière est une autre forme d’énergie. Les plantes se servent de l’énergie des rayons du soleil pendant le processus de photosynthèse. Dans cette réaction chimique, le dioxyde de carbone et l’eau réagissent pour former du glucose et de l’oxygène. Le glucose est un type de sucre que les plantes utilisent pour leur propre énergie.
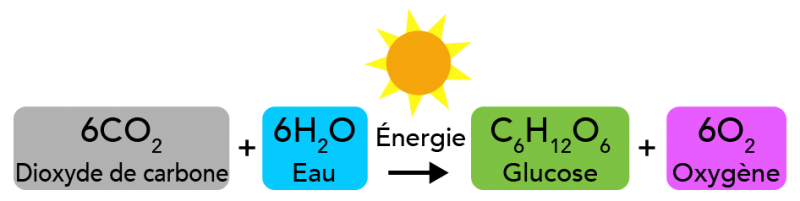
Image - Version texte
Pendant la photosynthèse, six molécules de dioxyde de carbone réagissent avec six molécules d’eau pour former une molécule de glucose (un sucre) et six molécules d’oxygène. Cette réaction nécessite de l’énergie du Soleil ou d’une autre source de lumière.
Certaines réactions de décomposition nécessitent aussi de la lumière. Un exemple d’un produit que l’on peut trouver à la maison est le peroxyde d’hydrogène. Nous utilisons le peroxyde d’hydrogène comme nettoyant et désinfectant. Lorsqu’il est exposé à la lumière, une réaction chimique se produit.
2H2O2 → 2H2O + O2
C’est pour cette raison que le peroxyde d’hydrogène se retrouve dans une bouteille brune opaque.
Savais-tu que notre corps subit aussi certaines réactions chimiques qui nécessitent de la lumière? Quand ta mère te disait d’aller à l’extérieur pour prendre un peu de soleil, penses-tu qu’elle cherchait seulement une excuse pour que tu quittes ta chambre? Peut-être… mais peut-être qu’elle essayait aussi de t’aider à faire le plein de vitamines! La vitamine D est une molécule très importante pour notre corps. Elle nous aide à absorber le calcium et le phosphore. Ce sont deux minéraux importants pour les dents et les os. Notre corps ne produit pas de vitamine D par lui-même. Il a besoin de l’aide des rayons du soleil. Dans les pays du Nord, comme au Canada, les gens ne sont parfois pas assez exposés à la lumière du soleil pendant les mois d’hiver. C’est pourquoi il est judicieux, à cette période de l’année, de consommer des aliments avec de la vitamine D ajoutée.

Les réactions qui nécessitent une pression
Dans les réactions chimiques, la pression agit de manière similaire à la température. Plus les molécules se compressent, plus elles sont proches les unes des autres. Et plus elles sont proches, plus elles sont susceptibles d’interagir.
Les molécules de gaz dans notre atmosphère exercent elles aussi une pression sur Terre. Certaines réactions chimiques sur Terre sont affectées par cette pression atmosphérique. Le gaz carbonique qui est dissous dans les océans en est un bon exemple. La pression permet à un peu de dioxyde de carbone d’être dissous dans l’eau des océans. Cette réaction produit de l’acide carbonique. C’est ce qu’on appelle l’acidification de l’océan. Ce phénomène se produit depuis toujours et atteint généralement un équilibre naturel. Les organismes vivants ont évolué de sorte à pouvoir tolérer ces niveaux naturels d’acidification. Cependant, le réchauffement climatique accélère cette réaction. Cela entraîne des problèmes pour les animaux des écosystèmes marins.
Le savais-tu?
Les diamants sont formés lorsque du carbone est exposé à des températures supérieures à 1000°C et à une pression 50 000 fois supérieure à la pression atmosphérique normale.
Nous n’avons pas étudié les effets de la pression sur les réactions chimiques autant que ceux de la chaleur. Toutefois, des recherches actuelles sont menées dans le domaine de la chimie « à haute pression ».
Les réactions qui nécessitent de l’électricité
L’électricité peut aussi être utilisée pour briser les liaisons qui maintiennent les molécules ensemble. La réaction la plus connue qui nécessite un courant électrique est l’électrolyse de l’eau.
Pour ce faire, tu as besoin d’une source d’électricité, comme une pile. Tu dois connecter la pile à deux morceaux de métal appelés électrodes. Nous appelons l’électrode positive une anode et l’électrode négative une cathode. Les électrodes sont placées dans l’eau, ce qui complète le circuit. L’électrode chargée attire les particules chargées, appelées ions, de la charge opposée. L’anode attire les ions négatifs et la cathode attire les ions positifs.
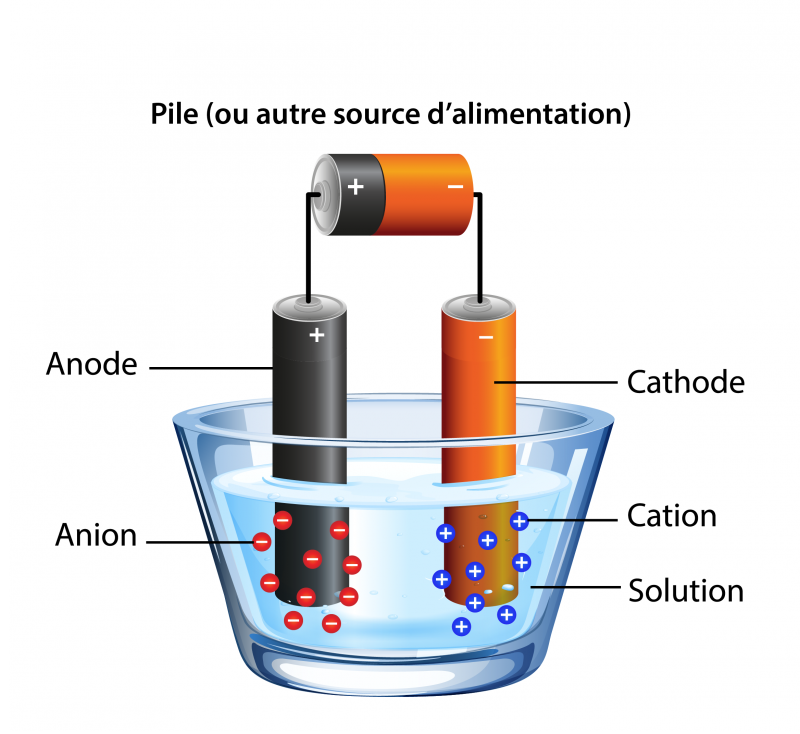
Image - Version texte
Un verre d’eau est partiellement rempli d’eau. Dans la solution, deux pièces de métal sont suspendues. Elles sont toutes deux reliées à une pile par des fils. Lorsque le circuit est fermé, les anions chargés négativement sont attirés par l’anode. Les cations chargés positivement sont attirés par la cathode.
À l’extrémité de l’anode, les molécules d’eau se divisent pour former de l’oxygène (O2) gazeux, des ions d’hydrogènes (H+) et des électrons (e-). Ce type de réaction s’appelle une réaction d’oxydation car elle libère des électrons libres.
2 H2O(l) → O2(g) + 4 H+(aq) + 4e−
À l’extrémité de la cathode, les ions d’hydrogène se combinent aux électrons pour former du H2 gazeux. Ce type de réaction s’appelle une réaction de réduction car elle nécessite des électrons libres.
2 H+(aq) + 2e− → H2(g)
Le savais-tu?
Pour te souvenir de la différence entre les réactions d’oxydation et les réactions de réduction, utilise l’aide-mémoire : « LÉO le lion diGER (digère) ». C’est-à-dire, Libération d’Électrons signifie Oxydation, Gain d’Électrons signifie Réduction.
La galvanoplastie est une autre réaction commune qui implique de l’électricité. Ce procédé consiste à appliquer une fine couche de métal sur une autre pièce de métal. La galvanoplastie est souvent utilisée pour appliquer une fine couche de métaux précieux, comme l’or ou l’argent, sur des objets comme les bijoux et la coutellerie. Examinons son fonctionnement.
Si nous voulions procéder à une galvanoplastie, nous aurions besoin de :
- Deux électrodes à base de matériaux conducteurs d’électricité, comme des métaux;
- Un électrolyte, qui est une solution capable de conduire l’électricité; et
- Une source d’électricité.
Par exemple, si nous voulions plaquer du cuivre sur un clou de fer, nous aurions besoin d’une électrode de cuivre, d’une électrode de fer et d’un électrolyte, comme une solution de sulfate de cuivre (CuSO4 (aq)). Si nous insérons les deux électrodes dans la solution et que nous connectons le circuit à une pile, le cuivre agira comme l’anode et le clou de fer agira comme la cathode. Lorsque le courant électrique passera à travers le circuit, le sulfate de cuivre se divisera en ions de cuivre (Cu++) et en ions de sulfate (SO4--). Les ions de cuivre seraient attirés par le clou de fer chargé négativement et formeraient une fine couche de cuivre sur le clou. Tandis que les ions de sulfate chargés négativement seraient attirés par l’anode de cuivre chargée positivement. Ces électrons supplémentaires passeraient ensuite par les fils jusqu’à la pile, puis redescendraient jusque dans le clou de fer.
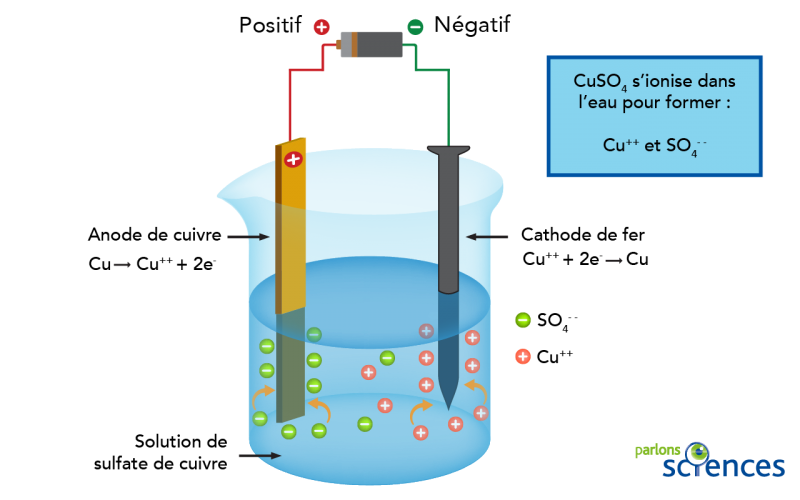
Image - Version texte
Un bécher en verre est partiellement rempli d’une solution de sulfate de cuivre bleu pâle. Une tige de cuivre et un clou de fer sont suspendus dans la solution. Ils sont les deux reliés à une pile par des fils. Lorsque le circuit est fermé, les ions de sulfate sont attirés par l’anode en cuivre. Les ions de cuivre sont attirés par la cathode de fer.
Ce procédé n’est pas instantané, mais tant qu’il y a des ions et des électrons en mouvement, ce procédé a lieu.
Les catalyseurs
Certaines réactions chimiques nécessitent des catalyseurs. Les catalyseurs sont des substances qui contribuent à une réaction sans y prendre part directement. Ils abaissent la quantité d’énergie nécessaire pour amorcer une réaction. Tu te souviens de la réaction de décomposition du peroxyde? Tu peux accélérer cette réaction en ajoutant des levures qui ont un catalyseur spécial. Fais-en l’expérience!
Les catalyseurs sont importants pour de nombreux procédés industriels. Ils accélèrent les réactions, ce qui permet d’en réduire les coûts. Et puisque les catalyseurs ne participent pas directement aux réactions, ils peuvent être utilisés encore et encore. Les convertisseurs catalytiques reposent sur le même principe. Ils empêchent les polluants atmosphériques toxiques de s’échapper des tuyaux d’échappement des véhicules.
Les enzymes représentent un type particulier de catalyseur qui est essentiel à nos vies. Les enzymes accélèrent toutes sortes de réactions dans notre corps. Elles participent à la façon dont nous utilisons l’oxygène et elles contribuent à notre croissance. Contrairement à la plupart des catalyseurs industriels, qui sont des composés simples, les enzymes sont des protéines complexes.
Parfois, c’est complexe!
L’ammoniac (NH3) est l’un des produits chimiques les plus communs produits par les humains. Il est essentiel à la production d’engrais et à la fabrication de produits pharmaceutiques. Il se retrouve aussi dans de nombreux produits nettoyants. L’ammoniac est même envisagé comme une énergie verte potentielle. L’ammoniac est produit en combinant de l’azote atmosphérique (N2) gazeux et de l’hydrogène gazeux (H2).
N2(g) + 3H2(g) → 2NH3(g)
Pour ce faire, tu as besoin d’une température élevée, d’une forte pression et d’un catalyseur!
En savoir plus
Comment accélérer les réactions chimiques (et trouver un partenaire pour le bal) (2012)
Cette vidéo (4 min. 56 s.) avec sous-titres français de TedEd explique les différentes façons d’accélérer les réactions chimiques.
Galvanoplastie sur du plastique !
Cette vidéo (2 min. 3 s.) du Petit Chimiste présente la théorie et une expérience de cuivrage d’un morceau de plastique.
L'électrolyse de l'eau (2017)
Cette vidéo d’AlloProf (2 min. 59 s.) présente la théorie et une démonstration de l’électrolyse de l’eau.
Catalyseur - Définition et Explications
Cette page de Techno Science présente des exemples de catalyseurs.
Les catalyseurs (2014)
Cette vidéo (3 min. 8s.) d’Unisciel présente ce que sont les catalyseurs et à quoi ils servent..
Les facteurs qui influencent la vitesse de réaction
Cette page d’Allo Prof présente les facteurs qui influencent la vitesse d’une réaction chimique.
Références
Dillon, S.R. (n.d.) The Rates of Chemical Reactions. Chemistry For Liberal Studies - Forensic Academy. Retrieved from https://www.chem.fsu.edu/chemlab/chm1020c/Lecture%208/01.php
Electrolysis: Using Electricity to Do Chemistry. (2019, July 1). Retrieved from https://chem.libretexts.org/@go/page/161969