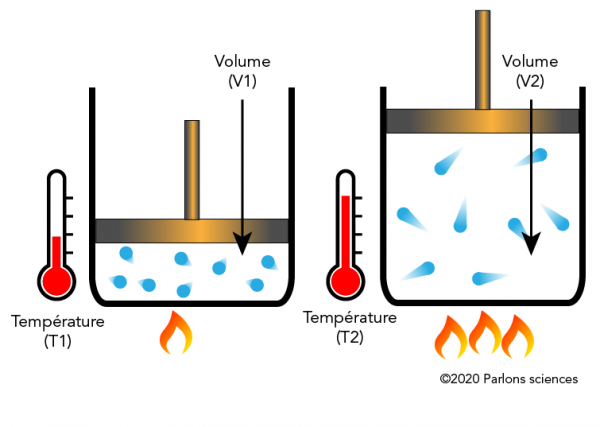
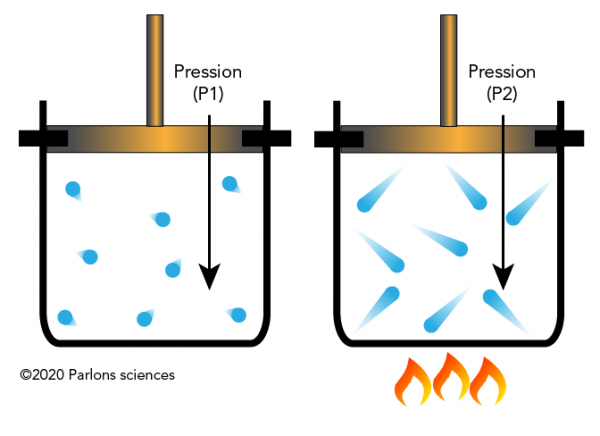
La loi de Charles et La loi de Gay-Lussac

Montgolfières (sjlayne, iStockphoto)

Montgolfières (sjlayne, iStockphoto)
8.6
Quels sont les liens avec mon programme d'études?
AB
8
Connaissances et employabilité Sciences, 8e et 9e années (2007)
Unité A: Mélanges et circulation de la matière
AB
8
Sciences 7e, 8e et 9e années Programme d'études (Révision 2014)
Unité A: Mélanges et circulation de la matière
NS
8
Sciences 8e année (2020-21)
Les apprenants mettront à l'essai les effets des changements de température et de pression sur les propriétés des fluides.
NU
8
Connaissances et employabilité Sciences, 8e années (Alberta, 2007)
Unité A: Mélanges et circulation de la matière