Introduction à l’atome

Modèle du nuage électronique d’un atome (koto_feja, iStockphoto)

Modèle du nuage électronique d’un atome (koto_feja, iStockphoto)
Quels sont les liens avec mon programme d'études?
Découvre les parties d’un atome et son histoire.
L’atome
Selon la théorie des particules de la matière, toute la matière est constituée de minuscules particules. Ces particules sont soit des atomes individuels ou des groupes d’atomes appelés molécules. Un atome comporte deux principaux composants. Il s’agit du noyau et des électrons.
Le noyau
Au centre de chaque atome se trouve le noyau. Dans le noyau, il existe deux sortes de particules : les particules chargées positivement nommées protons et les particules sans charges nommées neutrons. Les protons donnent au noyau une charge positive. Par exemple, un atome d’hélium possède 2 protons et 2 neutrons. Il a une charge nucléaire de +2. Un atome de carbone a 6 protons et 6 neutrons. Il a une charge nucléaire de +6.
Image - Version texte
Voici une illustration en couleur des protons et des neutrons de deux noyaux différents.
Le schéma de gauche correspond au « noyau de l’atome d’hélium ». Il est composé de deux types de sphères différentes, disposées en un amas serré. Il y a deux sphères rouges avec le symbole « + » blanc. Ces sphères correspondent aux « protons : particules à charge positive ». Il y a aussi deux sphères orange unies. Ces sphères correspondent aux « neutrons : particules à charge négative ». L’ensemble des particules correspond à « 2 protons, 2 neutrons ». Il est aussi indiqué « charge nucléaire +2 ».
Le schéma de droite correspond au « noyau de l’atome de carbone ». Ce noyau est composé de six sphères rouges avec le symbole « + » et de six sphères orange, positionnées en amas. Le schéma correspond à « 6 protons, 6 neutrons ». Il est aussi indiqué « charge nucléaire +6 ».
Le savais-tu?
Ce n’est qu’en 1932 que les neutrons ont été découverts. C’est le scientifique James Chadwick qui a fait la découverte de leur existence
Le nombre de protons dans le noyau détermine le type d'atome. Par exemple, tous les atomes d'or ont 79 protons et tous les atomes d'argent ont 47 protons. L'interaction nucléaire forte est le nom de la force qui maintient les protons et les neurones ensemble dans le noyau.
Les électrons
Gravitant autour du noyau se trouvent de minuscules particules chargées négativement appelées électrons. les électrons sont 2 000 fois plus petites que les protons et les neutrons. Cela signifie que la plus grande partie de la masse d’un atome se situe dans son noyau. Les électrons se déplacent extrêmement vite.
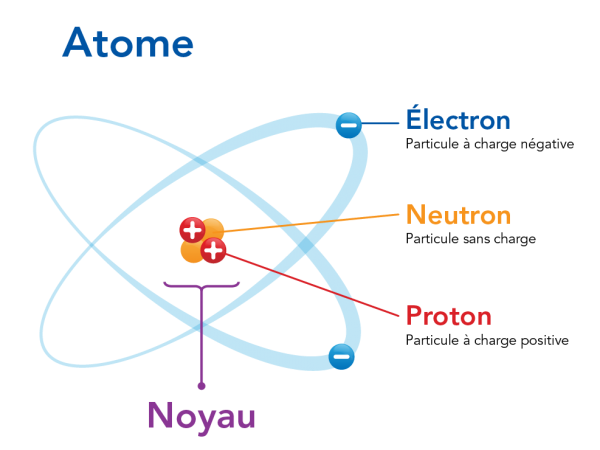
Image - Version texte
Voici un schéma en couleur d’un atome montrant des électrons se déplaçant autour d’un noyau. Le schéma porte le titre « Atome ». Au centre du schéma se trouve un amas de trois sphères rouges avec le symbole « + » et trois sphères orange. La sphère rouge correspond à un « proton : particule à charge positive ». La sphère orange correspond à un « neutron : particule sans charge ». Cet amas correspond au « noyau ». Autour du noyau se trouvent trois sphères bleues avec le symbole « - ». Il est indiqué que la sphère représente un « électron : particule à charge négative ». Chaque électron gravite autour du noyau sur une trajectoire ovale distincte, illustrée en bleu pâle. Les électrons sont en mouvement, déployés en éventail de façon régulière autour du noyau situé au centre.
C’est grâce aux forces électrostatiques que les électrons peuvent continuer de se déplacer près du noyau. Ce sont les forces qui attirent les particules chargées négativement et positivement les unes vers les autres.
Mais les électrons ont aussi de l'énergie cinétique. Celle-ci les pousse à s'éloigner du noyau. Dans un atome stable, ces deux forces sont équilibrées. Les électrons sont ainsi maintenus dans certaines zones autour du noyau.
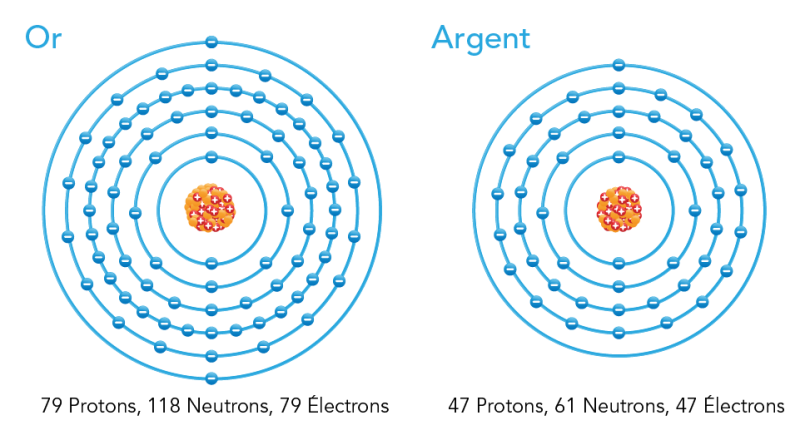
Dans la nature, la plupart des atomes sont stables. Un atome stable possède le même nombre d’électrons et de protons. Par exemple, un atome d’or a 79 protons et 79 électrons. L’atome d’argent a 47 protons chargés positivement et 47 électrons chargés négativement. Ces charges positives et négatives s’annulent. Cela signifie que les atomes stables ont une charge neutre.
Image - Version texte
Voici une illustration en couleur de deux atomes différents. Les neutrons sont représentés sur des cercles qui gravitent autour d’un noyau au centre. L’atome de gauche correspond à l’atome de l’« or ». Il comporte un amas de sphères orange et de sphères rouges avec le symbole « + » au centre. Des sphères bleues avec le symbole « - » sont disposées le long de six cercles bleus qui entourent l’amas de sphères. Le texte sous le schéma indiqué « 79 protons, 118 neutrons, 79 électrons ». L’atome de droite correspond à l’atome de l’« argent ». Il comporte un amas de sphères orange et de sphères rouges avec le symbole « + » au centre. Quelques sphères bleues avec le symbole « - » sont disposées le long de cinq cercles bleus. Le texte sous le schéma indique « 47 protons, 61 neutrons, 47 électrons ».
Le savais-tu?
Toute particule plus petite qu’un atome est appelée une particule subatomique. Les protons, les neutrons et les électrons sont tous des particules subatomiques.
Les modèles atomiques
Il est particulièrement difficile pour les gens de comprendre les choses qu’ils ne peuvent pas voir. C’était le cas de l’atome. Au fil du temps, les scientifiques ont créé différents modèles scientifiques. Ils l’ont fait à mesure qu’ils réalisaient des expériences et effectuaient des observations.
Le modèle du plum-pudding de Thomson
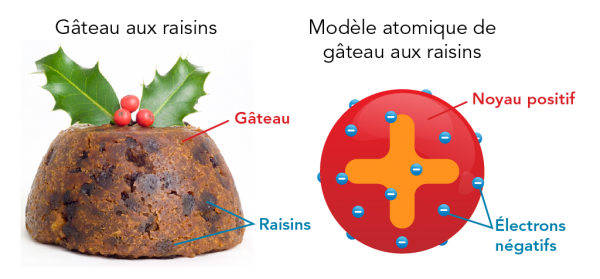
Au début du 20e siècle, J.J. Thomson a mené des expériences pour en apprendre davantage sur l’atome. Il a démontré que les atomes étaient composés de particules chargées positivement et négativement. Ce dont il n’était pas sûr, c’est comment ces éléments existaient ensemble. Son idée à l’époque était que les électrons négatifs étaient coincés dans une sphère positive. Il a imaginé que l’atome ressemblait à un populaire gâteau de Noël contenant des raisins. C’est pourquoi le modèle de Thomson est aussi connu sous le nom de modèle du gâteau aux raisins. Ceci est un traduction libre de l’original plum-pudding, un dessert populaire en Angleterre à cette époque.
Image - Version texte
Voici une image et un schéma en couleur qui illustrent le modèle atomique d’un gâteau aux raisins. L’image à gauche porte le titre « Gâteau aux raisins ». Elle montre un gâteau brun doré, en forme de dôme, avec des formes ovales brun foncé. La zone brune correspond au « gâteau », et les petits ovales foncés correspondent aux « raisins ». Sur le dessus se trouve une branche de houx avec deux feuilles vertes et trois baies rouges. Le schéma à droite porte le titre « Modèle atomique du gâteau aux raisins ». Il montre une sphère rouge avec un grand symbole « + » orange au centre. De petites sphères bleues avec un symbole « - » sont collées à la sphère rouge, un peu comme les raisins dans le gâteau. La zone rouge correspond au « noyau positif » et les sphères bleues correspondent aux « électrons négatifs ».
Le modèle planétaire de Rutherford
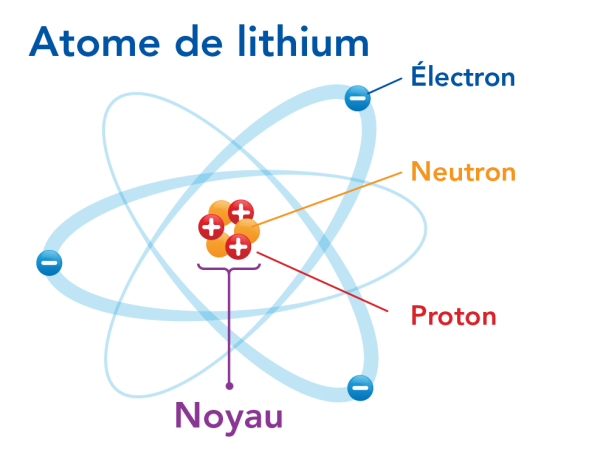
La compréhension de l’atome chez les scientifiques a changé en 1911. Ce changement est dû aux travaux effectués par Ernest Rutherford et son équipe. Principalement, ce fut l’expérience de la feuille d’or qui a permis d’élaborer ce nouveau modèle. Ils ont découvert que la charge positive de l’atome semblait concentrée en son centre. Rutherford a appelé cet espace le noyau. Il a aussi prédit que les électrons gravitaient autour du noyau, comme les planètes autour du soleil. C’est pourquoi le modèle de Rutherford porte aussi le nom de modèle planétaire. Tu as probablement déjà vu ce modèle de l’atome. L’atome de lithium, tel que celui illustré ci-dessous, est souvent utilisé comme symbole pour représenter la science!
Image - Version texte
Voici un schéma en couleur d'un atome montrant des électrons se déplaçant autour d'un noyau. Le schéma porte le titre « Atome de lithium ». Au centre du schéma se trouve un amas de trois sphères rouges avec le symbole « + » et trois sphères orange. La sphère rouge correspond à un « proton : particule à charge positive ». La sphère orange correspond à un « neutron : particule sans charge ». Cet amas correspond au « noyau ». Autour du noyau se trouvent trois sphères bleues avec le symbole « - ». Il est indiqué que la sphère correspond à un « électron : particule à charge négative ». Chaque électron gravite autour du noyau sur une trajectoire ovale distincte, illustrée en bleu pâle. Les électrons sont en mouvement, déployés en éventail de façon régulière autour du noyau situé au centre.
Le modèle de Bohr
Le modèle planétaire de Rutherford expliquait beaucoup de choses. Mais il ne permettait pas de répondre à certaines questions que se posaient toujours les scientifiques. Ceux-ci se demandaient où se trouvaient réellement les électrons et s’il était possible de prédire leur emplacement. Ils se demandaient aussi pourquoi les électrons en orbite ne perdaient pas d’énergie et ne s’écrasaient pas dans le noyau. Heureusement, le scientifique danois Niels Bohr a cherché à trouver des réponses à ces questions.
Bohr faisait partie d’un groupe de scientifiques intéressés par un nouveau domaine de la science appelé mécanique quantique. La mécanique quantique est l’étude de la façon dont les particules atomiques existent et interagissent les unes avec les autres. Bohr était particulièrement intéressé par l’énergie que possédaient les électrons. Les scientifiques commençaient à avoir une meilleure compréhension de l’énergie et des particules subatomiques. Sur cette base, Bohr a suggéré que les électrons orbitent autour du noyau selon des trajectoires précises. Il a désigné celles-ci sous le nom de couches électroniques. Tu te rappelles les modèles atomiques de l’or et de l’argent ci-dessus? Il s’agissait de modèles de Bohr. Les couches électroniques sont étiquetées à l’aide de lettres (K, L, M, N, O, P, Q) ou de nombres quantiques (n=1 à n=7).
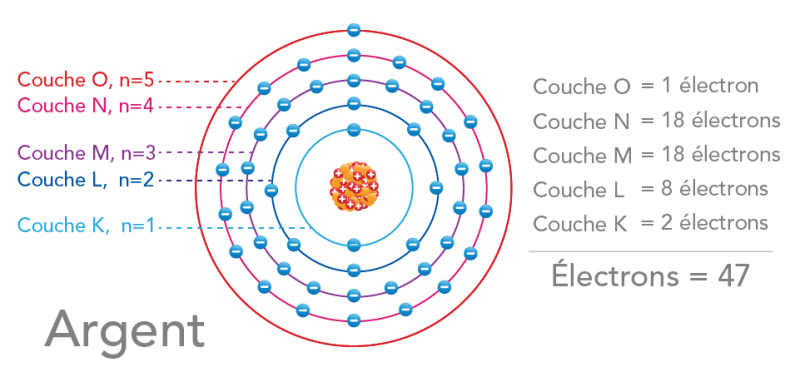
Image - Version texte
Voici un schéma en couleur d’un atome d’argent avec des enveloppes d’électrons de différentes couleurs, identifiées par des lettres et des nombres quantiques. Le titre « Argent » se trouve dans le coin inférieur gauche. Au centre, un noyau est illustré par un amas de sphères orange et de sphères rouges avec le symbole - ». Autour, il y a cinq cercles colorés. En commençant au plus près du noyau, le premier cercle est bleu pâle. Il est identifié comme suit : « Couche K, n=1 ». Le cercle suivant est bleu foncé et correspond à la « Couche L, n=2 ». Le suivant est violet et correspond à la « Couche M, n=3 ». Le suivant est rose et correspond à la « Couche N, n=4 ». Le cercle le plus à l’extérieur est rouge et correspond à la « Couche O, n=5 ». À droite, on retrouve une liste des couches avec le nombre d’électrons qu’elles contiennent. On peut y lire : « Couche O = 1 électron, Couche N = 18 électrons, Couche M = 18 électrons, Couche L = 8 électrons, Couche K = 2 électrons ». Sous une ligne horizontale en bas, le total est indiqué en caractères gras : « Électrons = 47 ».
Le modèle du nuage électronique
Le modèle de Bohr est rapidement devenu très populaire. Il est encore utilisé de nos jours parce qu’il nous aide à comprendre comment et pourquoi les atomes interagissent entre eux. Mais les scientifiques n’avaient pas encore fini d’essayer de comprendre à quoi ressemblent les atomes.
Le physicien autrichien Erwin Schrödinger a poussé le modèle de Bohr un peu plus loin. En 1926, il a proposé un modèle dans lequel il décrivait la probabilité de trouver un électron à un endroit donné. Ce modèle est connu sous le nom de modèle du nuage électronique ou modèle de la mécanique quantique. Les dessins de nuages électroniques ressemblent à des formes floues. Là où la forme est la plus dense, les chances d’y trouver un électron sont les plus élevées. L’endroit où un électron est le plus susceptible de se trouver est appelé son orbitale.
Image - Version texte
Voici un schéma en noir et blanc d’un électron composé de centaines de minuscules points noirs. Le schéma ressemble à un tas de poivre, ou à de la poudre noire, répandue sur une table, mais disposée en cercles précis. Au centre, il y a un petit anneau sombre et épais, comme un beigne. Les points noirs sont concentrés le long de la forme de l’anneau, où ils semblent épais et sombres. Les bords deviennent flous, et les points plus dispersés. Il s’agit du « noyau ». Un anneau beaucoup plus grand, plus fin et plus flou se trouve autour du noyau central. Les points sont moins denses, ce qui permet de les voir individuellement. Ils sont concentrés le long de la forme de l’anneau, mais dispersés plus largement et finement sur les bords. Cet anneau correspond à un « Nuage d’électrons = orbitale d’électrons ».
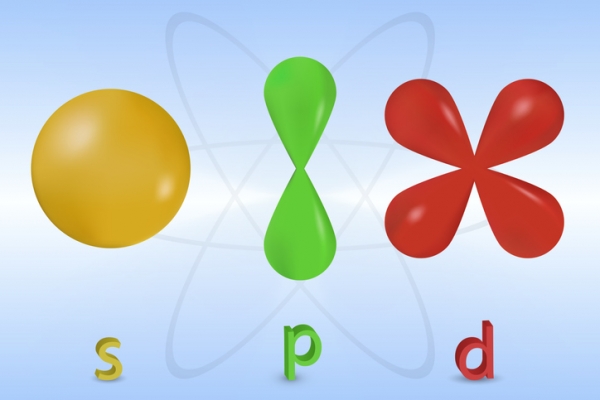
Tu te rappelles que le modèle de Bohr illustrait l’emplacement des électrons dans des couches? Cela est toujours important dans le présent modèle. Dans chaque couche se trouvent des sous-couches. Dans chaque sous-couche se trouvent un nombre précis d’orbitales. Chacune des sous-couches peut contenir un certain nombre d’électrons. Chacune a aussi une forme caractéristique. Ces formes peuvent devenir passablement complexes avec l’augmentation du nombre d’électrons. Le schéma ci-dessous présente les formes des sous-couches s, p et d.
Image - Version texte
Voici un schéma en couleur de trois formes lisses et arrondies différentes, qui ressemblent à des ballons. La première forme est une sphère jaune. Elle porte la lettre « s ». La deuxième forme est verte. Elle ressemble à deux gouttes d’eau disposées verticalement. La partie supérieure est à l’envers et la partie inférieure à l’endroit. Les deux gouttes se touchent aux extrémités. L’illustration porte la lettre « p ». La troisième forme est rouge. Elle ressemble à quatre gouttes d’eau. Ces dernières sont disposées en forme de X de façon que les extrémités se touchent au centre. L’illustration porte la lettre « d ».
Les modèles atomiques sont un excellent exemple de l’évolution de la pensée scientifique au fil du temps, ainsi que de la façon dont les nouveaux outils, comme la modélisation informatique, peuvent conduire à de nouvelles conceptions du fonctionnement des choses.
En savoir plus
Les atomes – épisode 22
Cet épisode d’Eureka! (4 min 51 s) explore la nature des atomes.
Les électrons – épisode 23
Cet épisode d’Eureka! (4 min 50 s) explore ce que sont les électrons et présente quelques modèles atomiques.
L’atome
Cette ressource d’Edumedia est une brève histoire de l’atome et inclut des animations de différents modèles atomiques.
L'histoire du modèle atomique
Cet article d'Alloprof explique l'histoire du modèle atomique et son évolution au fil du temps.
Quelle taille fait un atome?
Cette vidéo (4 min 57 s, en anglais avec sous-titres français) de Kurzgesagt illustre la taille des atomes.
L’origine de la matière – Dossier #28
Cette émission (42 min 43 s) de L’Esprit Sorcier explique l’histoire (à partir de 8 min 43 s) de la théorie atomique, jusqu’à la découverte des particules élémentaires par le CERN.
Références
Brittanica. (n.d.). Orbital.
cK-12. (2018). 3.17 Electron Cloud Atomic Model.
Compound Chemistry. (2016, Nov. 16). The History of the Atom.
Crash Course. (2013). Orbitals: Crash Course Chemistry #25.
Deziel, C. (2018). What Is an Unstable Atom? Sciencing.com.
Helmenstine, A.M. (2019, May 6). Basic Model of the Atom and Atomic Theory. Thought Co.
Khan Academy. (n.d.). The quantum mechanical model of the atom.
Khan Academy. (n.d.). Bohr’s model of hydrogen.
Lumen. (n.d.). Reading: Electrons.
Paterson, D. (2019, March 26). States of matter and particle theory. Education in Chemistry.
Scribblegoose. (2013). Quantum Mechanics: Schrödinger's discovery of the shape of atoms.
State Government of Victoria, Australia. (2020). Scientific Models.
Study.com. (n.d.). Modern Atomic Theory: Electron Clouds, Schrodinger & Heisenberg. Holt Physics online.
TechnologyUK. (n.d.). Electron Shells and Orbitals.
Williams, M. (2016. April 8). What Is The Electron Cloud Model? Universe Today.